주요 차이 - 강한 대 약한 전해질
전해질은 물에 용해 될 때 이온을주는 물질입니다. 세 가지 주요 유형의 전해질은 산, 염기 및 염이며, 이들 화합물은 물에 용해 될 때 이온에 분리된다. 양으로 하전되고 음으로 하전 된 이온은 이들 화합물의 수용액을 통해 전기를 전도 할 수있다. 일부 전해질은 강한 화합물이고 다른 전해질은 약한 전해질입니다. 강한 전해질과 약한 전해질의 주요 차이점은 강한 전해질이 이온에 거의 완전히 분리 될 수 있지만 약한 전해질은 부분적으로 이온으로 분리됩니다.
주요 영역을 다루었습니다
1. 강한 전해질은 무엇입니까
- 정의, 속성, 반응
2. 약한 전해질은 무엇입니까
- 정의, 속성, 반응
3. 강한 전해질과 약한 전해질의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :산, 염기, 전해질, 염, 강한 전해질, 약한 전해질 
강한 전해질
강한 전해질은 물에 용해 될 때 이온에 완전히 분리 할 수있는 화합물입니다. 따라서, 강한 전해질은 물에 완전히 용해되는 용질입니다. 전해질은 양이온 또는 양으로 하전 된 이온 및 음이온 또는 음으로 하전 된 이온으로 구성됩니다. 이 이온은 용액에서 전류를 전도 할 수 있습니다.
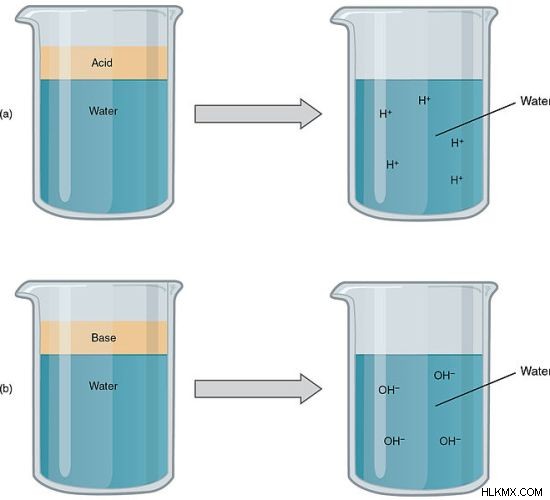
그림 1 :강산과 강한베이스는 강한 전해질입니다
일반적인 강한 전해질은 강산, 강한 염기 및 이온 소금입니다. 그러나 일부 전해질은 물에 완전히 용해되지 않지만 강한 전해질로 간주됩니다. 용해 된 양이 이온으로 완전히 이온화되기 때문입니다.
예를 들어, HCl, hno 3 와 같은 강산 강한 전해질입니다. 이들은 양이온 H와 음이온에 완전히 분리됩니다. Naoh와 같은 강력한베이스는 전기를 전도 할 수있는 이온으로 완전히 분리됩니다.
약한 전해질
약한 전해질은 물에 용해 될 때 이온에 부분적으로 분리되는 화합물입니다. 약한 전해질은 양이온 및 음이온으로 구성됩니다. 이들 화합물의 이온 성 특성은 강한 전해질과 비교할 때 적다. 일반적인 약한 전해질은 약산, 약한 염기 및 소금입니다.
일반적으로 화합물의 약 1-10%가 이온으로 분리됩니다. 대부분의 질소 함유 화합물은 약한 전해질입니다. 물 분자는 부분적으로 H 및 OH 이온으로 분리되기 때문에 물이 약한 전해질로 간주됩니다.
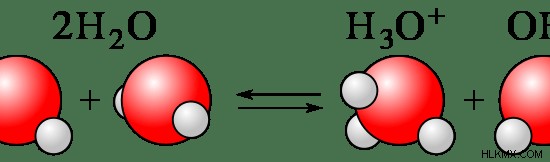
그림 2 :물 분자는 부분적으로 이온으로 분리됩니다
이 약한 전해질은 부분적으로 물에 용해되기 때문에 약한 전해질의 용액은 분자, 양이온 및 음이온으로 구성됩니다. 전기 전하 이온이 여러 개 있기 때문에 이러한 용액은 전류를 전도 할 수 있습니다.
일부 일반적인 약한 전해질은 h 2 와 같은 약산입니다. Co 3 및 NH 3 와 같은 약한 염기 . 약한 전해질의 경우, 해리 상수는 화합물의 해리가 전기를 전도 할 수있는 가용성 이온을 형성하기 때문에 용액을 통해 수행 될 수있는 전하의 용량을 예측하는데 중요하다.
.강한 전해질과 약한 전해질의 차이
정의
강한 전해질 : 강한 전해질은 물에 용해 될 때 이온에 완전히 분리 할 수있는 화합물입니다.
약한 전해질 : 약한 전해질은 물에 용해 될 때 부분적으로 이온에 분리되는 화합물입니다.
해리
강한 전해질 : 강한 전해질은 이온으로 완전히 분리 될 수 있습니다.
약한 전해질 : 약한 전해질은 부분적으로 이온으로 분리됩니다.
예제
강한 전해질 : 강한 전해질은 강산, 강한 염기 및 일부 염입니다.
약한 전해질 : 약한 전해질은 약산, 약한 염기 및 일부 소금입니다.
결론
전해질은 양이온과 음이온을 방출하기 위해 물에 용해 될 수있는 화합물입니다. 이들 이온은 용액을 통해 전기 전도에 기여할 수있다. 강한 전해질과 약한 전해질의 주요 차이점은 강한 전해질이 이온에 거의 완전히 분리 될 수 있지만 약한 전해질은 부분적으로 이온으로 분리된다는 것입니다.
.