주요 차이 - Disodium EDTA vs Tetrasodium edta
EDTA는 잘 알려진 킬레이트 에이전트입니다. 칼슘 및 마그네슘과 같은 금속 이온과 결합 할 수 있습니다. EDTA는 금속 이온의 "격리"를 유발합니다. 이것은 금속 이온과 결합하고 안정적인 EDTA- 금속 복합체를 형성함으로써 수행된다. Disodium EDTA 및 Tetrasodium EDTA는 많은 산업에서 사용되는 두 가지 형태의 EDTA입니다. 그들은 EDTA의 나트륨 염입니다. Disodium EDTA에는 2 개의 나트륨 양이온이 있으며, Tetrasodium EDTA는 분자 당 4 개의 나트륨 양이온을 갖는다. Disodium EDTA와 Tetrasodium EDTA의 주요 차이점은 disodium EDTA가 7보다 낮은 반면 Tetrasodium EDTA는 7보다 높은 pH를 가지고 있다는 것입니다.
주요 영역을 다루었습니다
1. disodium edta
- 정의, 구조, 사용
2. Tetrasodium edta
이란 무엇입니까? - 정의, 구조, 사용
3. Disodium EDTA와 Tetrasodium EDTA
의 유사점은 무엇입니까? - 일반적인 기능의 개요
4. Disodium EDTA와 Tetrasodium EDTA
의 차이점은 무엇입니까? - 주요 차이점 비교
주요 용어 :Disodium EDTA, EDTA, Edetate disodium, 나트륨 양이온, 테트라 소듐 EDTA 
disodium edta
disodium edta는 두 개의 나트륨 양이온으로 구성된 EDTA의 한 형태입니다. EDTA는 일반적으로 구조에 4 개의 음으로 하전 된 산소 원자를 갖는다. Disodium EDTA에서, 이들 산소 원자 중 2 개는 2 개의 나트륨 양이온과 결합된다. Disodium EDTA는 EDTA의 합성 부산물입니다. EDTA의 합성은 에틸렌 디아민, 포름 알데히드 및 시안 나이드 나트륨을 포함한다. 따라서, disodium EDTA에 존재하는 나트륨 이온은 시안 나이드 나트륨에서 나온다.
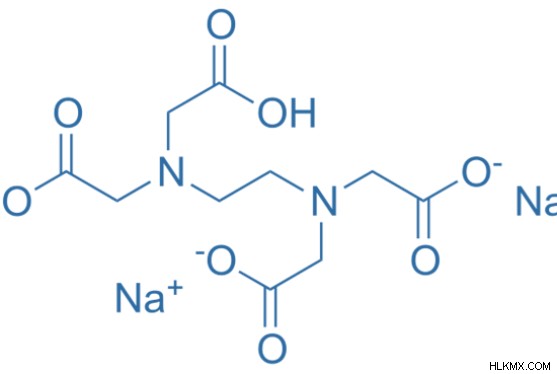
그림 1 :disodium edta의 화학 구조
disodium edta의 분자식은 c 10 로 제공됩니다. h 14 n 2 na 2 o 8 . 이 화합물의 몰 질량은 약 336.2 g/mol입니다. Disodium EDTA를 edetate disodium 이라고합니다 또한. 중금속 킬레이트 제입니다. 이 화합물은 건조 분말 또는 다른 고체 형태로 제공됩니다. 백색 결정 분말로 보입니다. 단식 EDTA 용액의 pH는 4에서 6까지 다양하지만 7을 초과하지 않습니다.
disodium edta는 우리가 일상 생활에서 사용하는 대부분의 제품에서 찾을 수 있습니다. 일부 예로는 샴푸, 헤어 염료, 로션, 샤워 젤 등이 있습니다. 제품의 저장 수명을 높이고 발포 특성을 향상시키기 위해 화장품에 추가됩니다. 의학에서 Disodium EDTA의 역할에는 킬레이트 요법, 항 응고 등이 포함됩니다. 그 외에도,이 화합물은 식품 첨가제로도 사용됩니다.
그러나 인간 의료 제품에서 Disodium EDTA의 적용과 관련하여 몇 가지 위험이 있습니다. 이 제품에서는 적은 양으로 사용되므로 유해한 성분으로 간주되지 않습니다. 그러나 피부 침투가 촉진되기 때문에 고객은 또한 우리 제품에 존재하는 다른 성분을 알고 있어야합니다.
테트라 소듐 edta
Tetrasodium EDTA는 4 개의 나트륨 양이온으로 구성된 EDTA의 한 형태입니다. EDTA는 4 개의 음으로 하전 된 산소 원자를 갖기 때문에, 이들 산소 원자는 테트라 소듐 EDTA 화합물의 나트륨 양이온에 결합된다. 이 화합물의 몰 질량은 약 380.1 g/mol입니다. 테트라 소듐 EDTA의 화학적 공식은 C 10 입니다 h 14 n 2 na 4 o 8 . 테트라 소듐 EDTA는 EDTA의 합성 부산물입니다.
Tetrasodium EDTA는 건식 분말, 액체 형태 등으로 제공됩니다. 그것은 무색 결정 가루로 보입니다. 테트라 소듐 EDTA는 수용성입니다. 에탄올에 약간 용해됩니다. 테트라 소듐 EDTA 용액의 pH는 10 내지 11 사이입니다.
테트라 소듐 EDTA의 주요 응용 프로그램에는 연수기 및 방부제로서의 사용이 포함됩니다. 이 화합물은 개인 관리 제품 및 화장품에 사용됩니다. 이 성분은 금속 이온을 격리하는 능력으로 인해 첨가됩니다. 이 격리는 테트라 소듐 EDTA가 금속 이온과 결합하여 제품의 다른 성분과 반응하는 것을 방지 할 수 있기 때문에 저장 수명을 증가시킵니다.
.
그림 2 :테트라 소듐 EDTA는 많은 화장품의 성분입니다
그러나 Tetrasodium EDTA는 사용에 따라 낮거나 중간 정도의 위험한 화합물로 간주됩니다. 그 효과는 피부 자극과 독성을 유발할 수 있습니다. 가장 중요한 것은 테트라 소듐 EDTA가 에코 톡신으로 인식됩니다 (환경에 해롭다).
disodium edta와 Tetrasodium edta 사이의 유사성
- 두 화합물 모두 EDTA 합성 공정의 부산물입니다.
- 두 화합물은 EDTA의 나트륨 염입니다.
- 두 화합물 모두 연수기와 방부제로 작용할 수 있습니다.
- 두 화합물 모두 개인 의료 제품 및 화장품의 성분으로 사용됩니다.
Disodium EDTA와 Tetrasodium edta의 차이
정의
disodium edta : Disodium EDTA는 2 개의 나트륨 양이온으로 구성된 EDTA의 한 형태입니다.
Tetrasodium EDTA : 테트라 소듐 EDTA는 4 개의 나트륨 양이온으로 구성된 EDTA의 한 형태입니다.
화학식
disodium edta : 단식 EDTA의 화학적 공식은 C 10 입니다 h 14 n 2 na 2 o 8 .
Tetrasodium EDTA : 테트라 소듐 EDTA의 화학적 공식은 C 10 입니다 h 14 n 2 na 4 o 8 .
몰 질량
disodium edta : Disodium EDTA의 몰 질량은 약 336.2 g/mol입니다.
Tetrasodium EDTA : 테트라 소듐 EDTA의 몰 질량은 약 380.1 g/mol입니다.
정상 pH
disodium edta : Disodium EDTA 용액의 pH는 4 내지 6입니다.
Tetrasodium EDTA : Tetrasodium EDTA 용액의 pH는 10에서 11 사이입니다.
결론
disodium edta 및 tetrasodium edta는 EDTA 합성 공정의 부산물입니다. 그들은 EDTA의 나트륨 염입니다. 이 화합물은 화장품 및 기타 인간 관리 제품의 방부제로 사용됩니다. Disodium EDTA와 Tetrasodium EDTA의 주요 차이점은 Disodium EDTA가 7보다 낮은 반면 Tetrasodium EDTA는 7보다 높은 pH를 가지고 있다는 것입니다.
.