주요 차이 - 클로로포름 대 염소
염소는 원자 번호 17을 갖는 화학 요소입니다. 그러나 일반적으로 염소라는 용어는 염소 가스 인 염소 가스 화합물이라고 부르는 데 사용됩니다. 염소 가스 및 기타 염소 함유 화합물은 소독제 및 다른 제품의 제조에 매우 유용합니다. 클로로포름은 메탄과 염소 가스 사이의 반응에 의해 형성된 일반적인 마취 화합물입니다. 클로로포름과 염소의 주요 차이점은 클로로포름이 실온에서 액체로 존재하며 무겁고 에테르와 같은 냄새와 달콤한 맛이있는 반면 염소는 황록색 가스로 존재하며 질식 냄새가납니다. .
주요 영역을 다루었습니다
1. 클로로포름이란?
- 정의, 화학적 특성, 생산, 사용
2. 염소 가란?
- 정의, 화학적 특성, 사용
3. 클로로포름과 염소의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :원자 수, 염화물, 염소, 클로로포름, 자유 라디칼 할로겐화, 동위 원소, 메탄, 사면체, 트리클로로 메탄

클로로포름이란?
Chloroform은 일반적인 마취제 (통증에 무감각을 유발하는 물질) 화학적 공식을 갖는 화학 종 CHCL 3 입니다. . 이 화합물의 몰 질량은 119.369 g/mol입니다. Trichloromethane 라고도합니다 클로로포름의 화학 구조는 염소 원자로 치환 된 3 개의 수소 원자로 메탄과 유사하기 때문에
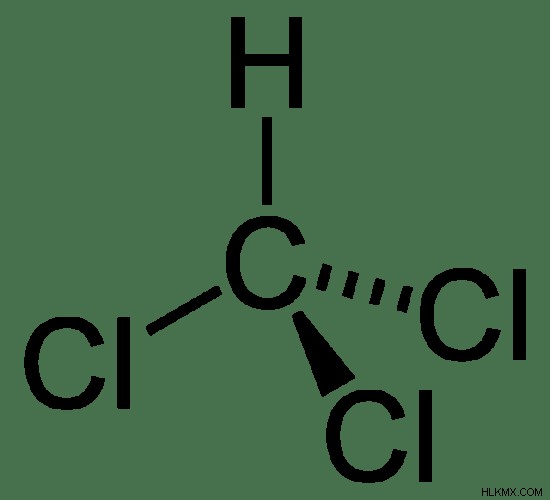
그림 1 :클로로포름의 화학 구조
실온에서 클로로포름은 휘발성이 높은 무색 액체로 존재합니다. 그것은 무겁고 에테르와 같은 냄새와 달콤한 맛이 있습니다. 클로로포름의 융점은 -63.5 ° C이고 끓는점은 61.15 ° C입니다. 그러나 450 ° C에서 분해됩니다. 클로로포름은 물에 약간 용해되지만 벤젠과 같은 유기 용매에서는 가용적입니다. 클로로포름은 물보다 밀도가 높습니다 (25C에서 1.489 g/cm). 클로로포름 분자의 형상은 사면체입니다.

그림 2 :클로로포름
클로로포름은 메탄의 염소화를 통해 생성됩니다. 여기서, 염소와 메탄의 혼합물은 약 400C로 가열된다. 염소화는 자유 라디칼 할로겐화로 발생합니다.
ch 4 + cl 2 → ch 3 Cl+HCl
ch 3 cl+ cl 2 → ch 2 cl 2 + hcl
ch 2 cl 2 + cl 2 → chcl 3 + hcl
클로로포름의 가장 중요한 사용은 클로로포름과 HF (수소 불화물) 사이의 반응을 통한 모노 클로로 디 플루오로 메탄 (CFC-22)의 생산입니다. 그것은 또한 지방, 오일, 고무 등에 대한 용매로 사용됩니다. 클로로포름의 수소 원자가 중수소 동위 원소로 대체되면 cdcl 3 를 제공합니다. , 이것은 NMR 분광법에 사용되는 용매입니다. 그러나 클로로포름의 가장 일반적인 사용은 마취제로 사용됩니다. 수술과 범죄 행위에도 널리 사용되었습니다. 그러나 수술에서 클로로포름의 사용은 이제 간 손상을 유발할 수 있으므로 엄격하게 통제됩니다.
염소가 뭐야
염소는 원자 번호 17을 갖는 화학 요소입니다. 염소는주기 테이블의 그룹 17에 있으며, 이는 할로겐 그룹이라고하며 p 블록에 속합니다. 비금속입니다. 염소의 전자 구성은 [NE] 3S3p입니다. 궤도를 완전히 채우기 위해 하나의 전자가 부족합니다. 따라서, 염소 원자는 매우 반응성이다; 염소는 전자 구성을 완료하기 위해 외부로부터 하나의 전자를 얻음으로써 -1 전하로 음이온을 형성한다. 그러나 일반적으로 염소라는 이름은 염소 규정형 가스를 지명하는 데 사용됩니다 (Cl 2 ).

그림 3 :구의 염소 가스
실온과 압력에서 염소는 황록색 가스로 존재합니다. 염소 가스는 질식 냄새가납니다. 염소의 동위 원소는 거의 없습니다. 가장 흔한 동위 원소는 염소 -35 및 염소 -37입니다. 그러나, 염소 -35는 높은 안정성으로 인해이 두 가지 중에서 가장 풍부한 동위 원소이다. 염소의 가장 안정적인 산화 상태는 -1입니다. 염소 원자는 외부 (전자 기부 화학 종에서)로부터 하나의 전자를 얻어 전자 구성을 완료하여 안정적인 전자 구성을 얻을 수 있습니다.
.염소 가스와 대부분의 다른 염소 함유 화합물은 박테리아를 죽일 수 있습니다. 따라서, 식수와 수영장 물을 치료하기위한 소독제로 사용됩니다. 그러나 염소 가스는 주로 PVC (폴리 비닐) 생산에 사용됩니다.
클로린 가스는 cl 2 때문에 산화제로 사용할 수 있습니다. 클로라이드 이온을 형성하기 위해 감소 될 수 있습니다 (클라 온은 클로라이드 이온으로 알려져 있음). 염소의 또 다른 주요 적용은 마취제 인 클로로포름의 이온 제조에 있습니다.
클로로포름과 염소의 차이
정의
클로로포름 : 클로로포름은 화학적 공식을 갖는 일반적인 마취 화학 종입니다. CHCL 3 .
염소 : 염소는 원자 번호 17과 기호 Cl을 갖는 화학 요소입니다. 그러나 일반적으로 규조류 염소는 염소라고도합니다.
몰 질량
클로로포름 : 클로로포름의 몰 질량은 119.369 g/mol.
입니다염소 : 염소 원자의 원자 중량은 35.453 amu입니다.
자연
클로로포름 : 클로로포름은 실온에서 휘발성 액체입니다.
염소 : 염소는 실온에서의 규조토 가스입니다.
물리적 특성
클로로포름 : 클로로포름은 무겁고 에테르와 같은 냄새와 달콤한 맛이 있습니다.
염소 : 실온과 압력에서 염소는 황록색 가스로 존재하며 냄새가 끊어집니다.
사용
클로로포름 : 클로로포름은 모노 클로로 디 플루오로 메탄의 생산에 사용되며 지방, 오일, 고무 등의 용매로 사용됩니다. 마취 화학 물질로 사용되었지만 이제는 사용이 제어됩니다.
.염소 : 염소 함유 화합물은 주로 소독제로 사용되며 염소는 PVC와 같은 화합물의 생산에 사용됩니다.
결론
클로로포름은 메탄과 염소 사이의 자유 라디칼 할로겐화 반응에서 생성됩니다. 클로로포름은 일반적으로 마취 화학 물질로 사용되었지만 이제는 간 손상으로 인해 사용량이 제어됩니다. 염소는 원자 번호 17을 갖는 화학 원소입니다. 실온에서는 이원성 염소 가스로 존재합니다. 클로로포름과 염소의 주요 차이점은 클로로포름이 실온에서 액체로 존재하며 무겁고 에테르와 같은 냄새가 있지만 염소는 황록색 가스로 존재하며 냄새가 cha다는 것입니다.
.참조 :
1.“염소 - 요소 정보, 속성 및 용도 | 주기적 테이블.” Royal Society of Chemistry, 여기에서 이용 가능.
2.“클로로포름.” 국립 생명 공학 정보 센터. Pubchem Compound Database, 미국 국립 의학 도서관,
3. Carey, Francis A.“클로로포름.” Encyclopædia Britannica, Encyclopædia Britannica, Inc., 2017 년 11 월 15 일, 여기에서 구입할 수 있습니다.
이미지 제공 :
1. Benjah-BMM27의 원본 이미지에 의해 "클로로포름", Fvasconcellos에 의해 벡터화-이미지 :chloroform-2d.png (public domain)에 의해 벡터화 된 Commons wikimedia
2. Danny S.-002 "-Commons Wikimedia