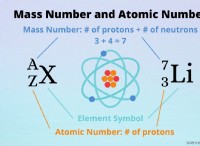
브롬이 염소보다 결합 엔탈피 에너지가 낮은 몇 가지 이유가 있습니다.
* 원자 반경 : 브롬 원자는 염소 원자보다 큽니다. 이는 BR-BR 결합의 전자가 CL-Cl 결합의 전자보다 더 많이 퍼져 있음을 의미합니다. 이것은 BR-BR 본드를 약하게 만듭니다.
* 전기 음성 : 브롬은 염소보다 전기 음성이 적습니다. 이것은 브롬 원자가 염소 원자만큼 강하게 전자를 유치하지 않음을 의미합니다. 이것은 또한 BR-BR Bond를 약하게 만듭니다.
* 원자가 전자 수 : 브롬은 염소보다 더 많은 원자가 전자를 가지고 있습니다. 이것은 BR-BR 본드에 관여 할 수있는 더 많은 전자가 있음을 의미합니다. 이것은 BR-BR Bond를 더 강하게 만듭니다.
이들 요인의 조합은 브롬이 염소보다 낮은 결합 엔탈피 에너지를 갖는 것을 초래한다.