균형 방정식 : 각 요소의 원자 수가 방정식의 양쪽에서 동일하도록 화학 방정식의 균형을 유지해야합니다. 균형 방정식은 특히 다수의 반응물 및 생성물과 관련된 복잡한 반응의 경우 도전적 일 수 있습니다.
반응물 및 제품 특이성 : 화학 방정식은 시작 재료 (반응물) 및 반응의 최종 생성물에 대한 정보 만 제공합니다. 반응 동안 형성된 반응 경로 또는 중간체에 대한 세부 사항을 제공하지 않습니다.
화학량 론 : 화학 방정식은 반응물과 생성물 사이의 정량적 관계를 지칭하는 반응의 화학량 론에 대한 정보를 제공합니다. 그러나 반응의 속도 또는 동역학에 대한 정보를 제공하지 않으므로 반응이 얼마나 빨리 발생하는지 결정합니다.
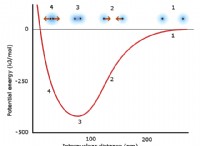
에너지 변화 : 화학 방정식은 반응 중에 발생하는 에너지 변화를 명시 적으로 보여주지 않습니다. 열 화학적 방정식은 반응과 관련된 엔탈피 변화를 나타내는 데 사용될 수 있지만 표준 화학 방정식과는 별개입니다.
반응 조건 : 화학 방정식은 일반적으로 온도, 압력 또는 촉매의 존재와 같은 반응이 발생하는 조건을 지정하지 않습니다. 이러한 요인들은 반응의 결과에 크게 영향을 줄 수 있습니다.
실제 복잡성 : 화학 방정식은 통제 된 환경에서 발생하는 반응의 단순화 된 표현을 나타냅니다. 실제 시나리오에서, 반응은 불순물, 부작용 및 기타 물질의 존재와 같은 다양한 요인에 의해 영향을받을 수 있으므로 화학 방정식에 따라 결과를 정확하게 예측하기가 어려워집니다.
양자 효과 : 고전적인 화학 개념에 기초한 화학 방정식은 매우 낮은 온도 또는 아 원자 입자에서 발생하는 것과 같은 양자 효과와 관련된 반응을 정확하게 설명하지 않을 수 있습니다.
이러한 한계에도 불구하고 화학 방정식은 화학 반응을 이해하고 표현하는 데 필수적인 도구로 남아 있습니다. 그들은 화학적 변형을 전달하고 화학량 론적 계산을 수행하는 간결하고 체계적인 방법을 제공합니다. 그러나 한계를 인식하고 다른 정보와 함께 화학 방정식을 사용하여 화학 반응 및 공정에 대한 완전한 이해를 얻는 것이 중요합니다.