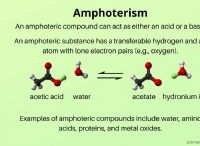
공유 화합물에서, 원자는 전자를 공유하여 강한 공유 결합을 형성함으로써 함께 결합된다. 이들 전자는 원자 사이에 국한되며 자유롭게 움직일 수 없으므로 이동 이온의 형성을 억제한다. 결과적으로, 공유 화합물은 중성 분자로서 존재하며 이온으로 분리되지 않는다.
대조적으로, 염화나트륨 (NaCl)과 같은 이온 성 화합물은 물에 쉽게 용해되거나 용융물을 녹여 자유롭게 움직이는 이온을 함유하는 용액 또는 용융 상태를 형성한다. NaCl의 경우 나트륨 (Na+) 및 클로라이드 (Cl-) 이온과 같은 이들 이온은 전류를 운반하여 이온 성 화합물을 전기 분해에 적합하게 만듭니다.
전류가 용액 또는 용융 이온 성 화합물을 통과 할 때, 이온은 반대로 하전 된 전극으로 끌린다. 양의 이온 (양이온)은 음성 전극 (음극)으로 이동하고 음이온 (음이온)은 양의 전극 (양극)으로 이동합니다. 이러한 이온의 움직임은 전극에서 화학 반응이 발생하여 화합물의 분해 또는 변형을 초래한다.
요약하면, 공유 화합물은 전기를 전도하기 위해 자유 이온이 없기 때문에 전기 분해를받지 않습니다. 전기 분해는 일반적으로 이온 성 화합물 또는 이동 이온을 함유 한 특정 용융 염에 적용 할 수 있습니다.