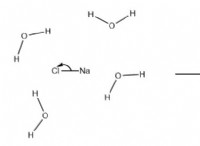
고체 KCl에서, 이온은 강한 정전기력에 의해 함께 고정된다. . 이 힘은 이온이 움직이지 않도록하므로 화합물은 전기를 전도 할 수 없습니다. KCl이 물에 용해 될 때, 물 분자는 이온을 둘러싸고 정전기력을 분리합니다. 이를 통해 이온이 자유롭게 움직일 수 있으며 화합물은 전기의 좋은 전도체가됩니다.
KCl이 녹을 때도 같은 일이 발생합니다. 용융 공정의 열은 이온 사이의 정전기력을 분리하여 자유롭게 움직여 전기를 전도 할 수 있습니다.
고체와 용융 KCl 사이의 전도도 차이는 이온의 이동성의 차이 때문입니다. 고체 상태에서는 이온이 움직이지 않으며 전기를 전도 할 수 없습니다. 용융 상태에서는 이온이 이동하여 전기를 전도 할 수 있습니다.