제한 반응물은 다른 반응물에 비해 가장 작은 두더지 비율로 존재하는 반응물이다. 이것은 각 반응물의 두더지를 균형 화학적 방정식에서 화학량 론적 계수로 나누어 결정할 수 있습니다. 가장 작은 두더지 비율을 갖는 반응물은 제한 반응물이다.
일단 제한 반응물이 확인되면, 이론적 수율은 균형 화학 방정식에서 생성물의 화학량 론적 계수에 의해 제한 반응물의 두더지에 곱하여 이론적 수율을 계산할 수있다. 이것은 반응에서 형성 될 수있는 최대 양의 제품을 제공합니다.
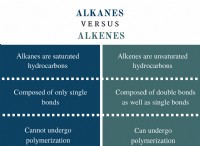
반응의 실제 수율은 일반적으로 반응, 불완전한 반응 및 정제 중 손실과 같은 요인으로 인해 이론적 수율보다 적습니다. 그러나, 이론적 수율은 반응의 효율을 평가하기위한 유용한 기준점을 제공한다.