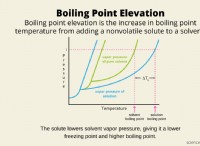
1. 물에 질산을 분리하기위한 균형 화학 방정식을 작성하십시오.
HNO3 + H2O → H3O + + NO3-
2. 용액에서 초기 농도, 농도 변화 및 평형 농도를 나타내는 아이스 테이블을 설정합니다.
| | HNO3 | H3O+ | no3- |
| --- | --- | --- | --- |
| 초기 | 0.0001m | 0m | 0m |
| 변경 | -X | +x | +x |
| 평형 | (0.0001-x) m | xm | xm |
3. 질산에 대한 산 해리 상수 (KA)에 대한 평형 농도를 발현으로 대체합니다.
ka =[h3o+] [no3-]/[hno3]
ka =x^2/(0.0001-X)
4. 질산의 KA는 매우 크기 때문에 (2.0 x 10^6) X가 0.0001보다 훨씬 작다고 가정하고 발현을 단순화 할 수 있습니다.
ka ≈ x^2/0.0001
x^2 ≈ 2.0 x 10^(-8)
x ≈ 1.4 x 10^(-4)
5. 공식을 사용하여 용액의 pH를 계산하십시오.
pH =-Log [H3O+]
pH =-log (1.4 x 10^(-4))
pH ≈ 3.85
따라서, 질산의 0.0001m 물 용액의 pH는 대략 3.85이다.