* 공동 속성 : 동결 지점 우울증은 공동 특성으로, 이는 화학적 동일성이 아니라 용액의 용질 입자의 * 수 *에 의존한다는 것을 의미한다.
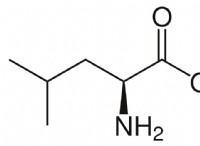
* 해리 : 표 (NaCl)는 물에 용해 될 때 2 개의 이온 (Na+ 및 Cl-)으로 분리되는 이온 성 화합물이다. 반면에 설탕 (수 크로스)은 해리되지 않는 분자 화합물입니다.
* 효과적인 농도 : 따라서, 1 몰의 표 염은 2 몰의 용해 된 입자 (이온)를 생성하는 반면, 1 몰의 설탕은 1 몰의 용해 된 입자만을 생성한다.
* 동결 지점 우울증 : 용해 된 입자의 수가 클수록 동결 지점의 우울증이 커집니다.
요약 :
* 1 mol의 테이블 소금은 용해 된 입자의 수의 두 배를 생성하기 때문에 물의 동결 지점을 1 mol 이상의 설탕을 낮추게됩니다.