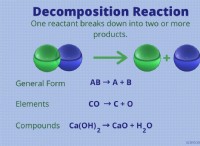
* 이온 : 이온은 전자를 얻거나 잃어버린 원자 또는 분자로 순 전하가 발생합니다.
* 양이온 : 양으로 하전 된 이온 (원자가 전자를 잃을 때 형성됨).
* 음이온 : 음으로 하전 된 이온 (원자가 전자를 얻을 때 형성됨).
* 이온 결합 : 반대로 하전 된 이온 사이의 강한 정전기 인력은 단단하고 결정질 구조로 함께 유지합니다.
이온 성 화합물의 주요 특성 :
* 높은 용융 및 끓는점 : 강한 이온 결합은 파손되기 위해 많은 에너지가 필요하므로 높은 용융 및 비등점이 생깁니다.
* 단단하고 부서지기 : 단단한 결정 구조는 어려워 지지만 이온은 압력으로 쉽게 서로를 미끄러 뜨려서 브리티 니스로 이어질 수 있습니다.
* 용융 상태 또는 솔루션에서 전기의 우수한 도체 : 용매에 용융되거나 용해되면 이온이 자유롭게 움직일 수있어 전기 전도가 가능합니다.
* 일반적으로 물에 가용성 : 극성 물 분자는 이온을 둘러싸고 분리하여 화합물을 용해시킬 수 있습니다.
이온 성 화합물의 예 :
* 염화나트륨 (NaCl) :나트륨 양이온 (Na+) 및 클로라이드 음이온 (Cl-)으로 구성된 일반적인 테이블 소금.
* 탄산 칼슘 (CACO3) :칼슘 양이온 (CA2+) 및 탄산염 음이온 (CO32-)에 의해 형성된 석회석 및 조개 껍질의 주요 성분.
* 산화 마그네슘 (MGO) :마그네슘 양이온 (MG2+) 및 산화물 음이온 (O2-)으로 구성된식이 보충제로서 다양한 응용 분야에 사용되는 흰색 고체.
이온 성 화합물의 형성 :
이온 성 화합물은 전형적으로 금속 원자 (전자를 잃는 경향)가 비금속 원자 (전자를 얻는 경향)와 반응 할 때 형성됩니다. 금속 원자는 전자가 양이온이되기 위해 전자를 잃고, 비금속 원자는 전자가 음이온이되기 위해 전자를 얻습니다. 이 반대로 하전 된 이온은 서로를 유치하여 이온 성 화합물을 형성합니다.