* 용해 된 이온 : NaCl이 물에 용해 될 때, 그것은 구성 이온에 분리됩니다 :Na+ 및 Cl-. 이것은 염화물 이온이 여전히 분리되지 않은 용액에 존재한다는 것을 의미합니다.
* 선택적 강수량 없음 : NaCl의 수용액으로부터 클로라이드 이온을 선택적으로 침전시키는 쉬운 방법은 없다. 나트륨을 침전시킬 수는 있지만 클로라이드 이온 용액이 남아있을 것입니다.
* 전기 분해 : 전기 분해를 사용하여 염화나트륨을 분리 할 수 있지만 이는보다 복잡하고 에너지 집약적 인 과정입니다.
수성 NaCl 용액을 사용하는 대신 클로라이드 이온을 분리하는 몇 가지 방법이 있습니다.
* 강수 반응 : 불용성 염화물 소금을 형성하는 시약을 사용하십시오. 예를 들어, 염화물 이온을 함유하는 용액에 질산은 (Agno3)을 첨가하면 염화은 침전물 (Agcl)을 생성합니다.
* 이온 교환 크로마토 그래피 : 이 기술은 클로라이드 이온에 선택적으로 결합하여 다른 이온에서 분리 될 수있는 수지를 사용합니다.
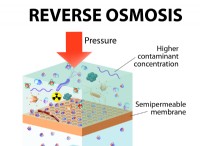
* 선택적 막 : 특정 막은 선택적으로 다른 이온을 차단하면서 염화물 이온이 통과하도록 허용 할 수 있습니다.
요약 : NaCl은 물에 용해되지만 염화물 이온을 분리하는 실용적인 방법을 제공하지 않습니다. 다른 화학적 또는 물리적 방법을 사용하여 분리해야합니다.