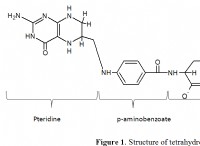
* 다수의 화합물은 동일한 백분율 조성을 가질 수있다 : 다음 예를 고려하십시오.
* 포름 알데히드 (ch₂o) 40% 탄소, 6.7% 수소 및 53.3% 산소의 비율이 있습니다.
* 아세트산 (c₂h₄o₂) 또한 40% 탄소, 6.7% 수소 및 53.3% 산소의 비율이 있습니다.
둘 다 동일한 백분율 구성을 가지고 있지만 분자 공식이 매우 다릅니다.
* 구성은 정확한 숫자가 아닌 비율을 나타냅니다. 계산 백분율은 화합물의 요소의 비율을 알려줍니다. 예를 들어, 85.7% 탄소 및 14.3% 수소의 백분율 조성을 갖는 화합물은 다음과 같습니다.
* ch₂ (가장 간단한 비율)
* c ₂h>
* c ₃h> , 그리고 그렇게.
분자식을 결정하려면 추가 정보가 필요합니다.
* 몰 질량 (분자량) : 화합물의 몰 질량을 알면 분자에 존재하는 각 요소의 정확한 수를 계산할 수 있습니다.
* 경험적 공식 : 이 공식은 화합물에서 요소의 가장 간단한 전체 수비율을 나타냅니다. 경험적 공식과 몰 질량에서 분자 공식을 결정할 수 있습니다.
요약
백분율 조성은 화합물에서 원소의 상대적 비율을 이해하는 데 유용한 도구이지만 실제 분자식을 결정하기에는 불충분합니다. 분자 내 각 요소의 정확한 원자 수를 결정하려면 어금니 질량과 같은 추가 정보가 필요합니다.