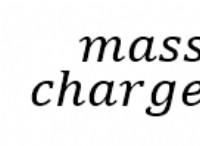* 산 : 물에 용해 될 때 수소 이온 (H+)을 생성하는 물질.
* 기지 : 물에 용해 될 때 수산화물 이온 (OH-)을 생성하는 물질.
반응 :
산과 염기가 물에 혼합되면 소금을 형성하기 위해 반응합니다. 및 물 .
화학 방정식 :
```
산 + 염기 → 소금 + 물
```
예 :
염산 (HCL)과 수산화 나트륨 (NAOH) 사이의 반응 :
```
HCl (AQ) + NAOH (AQ) → NACL (AQ) + H2O (L)
```
설명 :
* HCl은 물에서 H+ 이온을 방출하기 때문에 산입니다.
* Naoh는 물에서 오리온을 방출하기 때문에 기지입니다.
* 산으로부터의 H+ 이온은 염기의 옴과 결합하여 물을 형성한다 (H2O).
* 나머지 이온 (Na+ 및 Cl-)은 염, 염화나트륨 (NaCl)을 형성합니다.
키 포인트 :
* Arrhenius 이론은 물 속의 H+ 및 OHION의 형성에 중점을 둡니다.
*이 정의는 수용액의 반응으로 제한됩니다.
* 이론은 H+ 또는 오하이온 형성이없는 비 식 용매 또는 반응에서 반응을 설명하지 않습니다.
Arrhenius 이론은 산-염기 화학을 이해하는 기본 개념이지만 한계가 있습니다. Brønsted-Lowry 및 Lewis 이론과 같은보다 포괄적 인 이론은 산과 염기에 대한 광범위한 정의를 제공합니다.