* 전자 구성 : 전이 요소는 d- 궤도에 가장 바깥 쪽 전자를 가지며, 이들 D- 궤도는 실제로 가장 바깥 쪽 s- 궤도에 * 내부 *입니다.
* 에너지 수준 : S- 궤도는 일반적으로 에너지가 더 높지만 D- 궤도는 에너지가 매우 가깝습니다. 이 작은 에너지 차이는 D- 전자가 S- 전자와 함께 결합에 참여할 수있게한다.
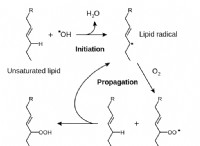
* 본딩 : 전이 요소가 결합을 형성 할 때, D- 전자는 종종 S- 전자와 함께 관여한다. 이것이 바로 전이 금속이 가변 산화 상태를 나타내고 다양한 화려한 화합물을 형성하는 이유입니다.
예 : 예를 들어 철 (FE)을 가져 가자 :
* 지상 상태 : Fe의 전자 구성은 [ar] 3d⁶ 4S²입니다.
* 이온화 : Fe가 이온을 형성하면 (Fe²⁺ 또는 Fe³⁺와 같은) 전자를 잃습니다. 이 전자는 주로 4S 궤도에서 나오지만 3D 전자도 관여 할 수 있습니다.
요약 : 전이 요소에는 말 그대로 * 이동 *으로 전자가 없습니다. D- 전자는 이미 내부 쉘에 위치하고 있으며, 가장 바깥 쪽 S- 전자와의 에너지 근접성은 결합에 참여할 수있게한다. 이것은 화학적 특성에서 전환 요소를 독특하게 만들고 그들의 독특한 특성을 제공합니다.