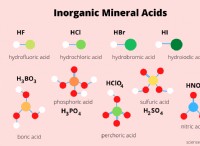
이유에 대한 분석은 다음과 같습니다.
* 이상적인 가스 가정 : 이상적인 가스 이론은 가스 분자에 부피가 없으며 서로 상호 작용하지 않는다고 가정합니다. 이것은 계산을 단순화하지만 실제 시나리오에서는 완전히 정확하지 않습니다.
* 실제 가스 부피 : 실제 가스 분자는 매우 작지만 유한 한 부피를 차지합니다. 이것은 그들이 움직일 수있는 공간이 컨테이너의 총 부피보다 약간 작다는 것을 의미합니다.
* 분자간 힘 : 실제 가스 분자는 특히 높은 압력과 온도에서 서로를 유치합니다. 반 데르 발스 (Van der Waals)의 힘과 같은 이러한 매력은 분자가 독립적 인 것으로 가정되는 이상적인 가스 거동에서 벗어나게한다.
요약 : 실제 가스 분자의 유한 부피 및 분자간 힘은 이상적인 가스 법칙, 특히 고압 및 저온에서 편차를 유발합니다.