이유는 다음과 같습니다.
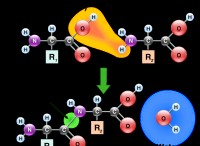
* 엔탈피 (H) 시스템의 총 에너지를 나타내는 열역학적 특성입니다. 여기에는 내부 에너지 (화학 결합의 에너지와 같은)와 압력 및 부피와 관련된 에너지가 포함됩니다.
* 엔탈피의 변화 (ΔH) 제품과 반응의 반응물 사이의 엔탈피의 차이입니다.
* 발열 반응 : 주변에 열을 방출합니다 (ΔH는 음수). 제품은 반응물보다 엔탈피가 낮습니다.
* 흡열 반응 : 주변에서 열을 흡수하십시오 (ΔH는 양수). 제품은 반응물보다 엔탈피가 더 높다.
요약 : 엔탈피의 변화에 의해 나타나는 반응물과 생성물 사이의 에너지 차이는 화학 반응 동안 열이 방출되거나 흡수되는지 여부를 결정한다.