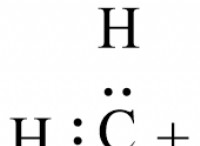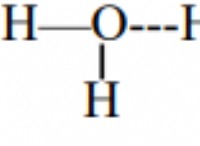동결 지점을 낮추기 (동결 지점 우울증) :
* 물 구조의 파괴 : 소금 (NaCl)이 물에 용해되면 나트륨 (Na+) 및 클로라이드 (Cl-) 이온으로 분해됩니다. 이들 이온은 물 분자 사이의 정상적인 수소 결합을 방해합니다. 물 분자는 일반적으로 동결 될 때 구조화 된 결정질 격자를 형성합니다. 이온은이 형성을 방해하여 물이 굳어지기가 더 어려워집니다.
* 더 많은 에너지가 필요하다 : 결과적으로, 물은 얼어 붙기 위해 0 ° C (32 ° F)보다 더 차가워야합니다. 이 온도의 차이를 동결 지점 우울증이라고합니다.
* 금액이 중요합니다 : 소금이 더 많이 녹을수록 얼어 붙은 지점 우울증이 커집니다.
융점 높이기 (끓는점 높이) :
* 유사한 메커니즘 : 동결 지점을 낮추는 것과 동일한 원칙도 끓는점에도 적용됩니다. 용해 된 이온은 물 구조를 방해하고 물 분자가 증기 상으로 빠져 나가기가 더 어려워집니다.
* 더 높은 온도 필요 : 결과적으로, 물은 100 ° C (212 ° F)보다 뜨거워 끓여야합니다.
왜 이것이 중요한가?
* 도로 디 싱크 : 소금은 물이 얼어 붙는 지점을 낮추기 때문에 겨울에는 도로에서 얼음과 눈을 녹이는 데 사용됩니다. 이것은 단단한 얼음 층의 형성을 방지하여 운전을 위해 도로를 더 안전하게 만듭니다.
* 음식 보존 : 소금은 음식 내부의 물의 동결 지점을 낮추기 때문에 음식을 보존하는 데 사용됩니다. 박테리아가 자라기가 더 어려워집니다.
* 기타 응용 프로그램 : 동결 지점 우울증 및 끓는점 고도에는 다음을 포함한 다른 많은 영역에 응용 프로그램이 있습니다.
* 엔진의 부동액 : 부동액에는 냉각수의 동결 지점을 낮추는 화합물이 들어있어 추운 날씨에 얼어 붙지 않습니다.
* 바닷물 솔루션 : 바닷물은 담수보다 동결이 낮고 끓는점이 높기 때문에 바다는 겨울에 고체가 얼지 않는 이유입니다.
소금과 물에 대한 영향에 대한 다른 질문이 있으면 알려주세요!