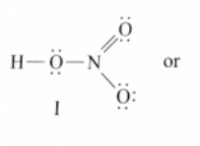
1. 발색단의 존재 :
* 발색단 공액 이중 또는 삼중 결합 시스템을 갖는 분자 내에서 기능적 그룹이다. 이 공액 시스템은 전자의 비편성을 허용하여 UV 방사선에 의해 흥분 될 정도로 충분히 가까운 에너지 수준을 갖는 분자 궤도를 생성합니다.
* 예 : 카르 보닐 (C =O), 알켄 (C =C), 방향족 고리 (벤젠) 및 니트로 그룹 (-NO2).
2. 적절한 전자 전환 :
* UV 흡수는 전자가 낮은 에너지 수준 (지면 상태)에서 더 높은 에너지 수준 (여기 상태)으로 전이 될 때 발생합니다.
*이 수준 사이의 에너지 차이는 UV 광자의 에너지에 해당해야합니다.
* 가장 일반적인 UV 전환은 다음과 같습니다.
* σ → σ* : 시그마 결합 (단일 결합)의 전자는 안티 딩트 시그마 궤도에 여기된다. 이 전환은 높은 에너지가 필요하며 원거리 UV 영역에서 발생합니다.
* n → σ* : 비 결합 궤도의 전자 (예를 들어, 고독 쌍)는 안티본 시그마 궤도에 여기됩니다. 이 전환은 또한 원거리 UV에서 발생합니다.
* π → π* : PI 결합 (이중 또는 삼중 결합)의 전자는 항체 PI 궤도에 여기된다. 이 전이는 가까운 UV 영역에서 발생하며 UV 흡수를 담당하는 가장 일반적인 유형입니다.
3. 컨쥬 게이션 정도 :
* 증가 된 컨쥬 게이션 : 공액 이중 결합의 더 큰 시스템은 전자 수준 사이의 더 작은 에너지 간격을 초래한다. 이로 인해 낮은 에너지 자외선 (더 긴 파장)이 흡수됩니다.
* 예 : 벤젠 (6 접합 된 PI 전자)은 에틸렌 (2 접합 된 PI 전자)보다 긴 파장에서 흡수된다.
4. 분자 구조 :
* 특정 분자 구조는 UV 흡수를 향상시킬 수 있습니다.
* 평면도 : 공액 시스템을 갖는 평면 분자는 P 궤도의 최대 겹침을 허용하여 전자의 비편 재화를 증가시키고 UV 흡수를 촉진합니다.
* 강성 : 고정 형태를 갖는 강성 분자는 유연한 분자보다 UV 활성 인 경향이있다.
요약하자면, 분자는 발색단을 함유하고 적절한 전자 전이를 겪을 수 있으며 컨쥬 게이션 및 평면도를 촉진하는 구조를 갖는 경우 UV 활성입니다.
참고 : UV 흡수는 정량적 현상입니다. UV 흡수의 강도는 분석 물의 농도 및 UV 빔의 경로 길이와 관련이 있습니다. 이 관계는 Beer-Lambert의 법칙에 의해 설명됩니다.