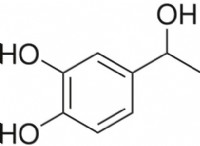
다음은 프로세스의 고장입니다.
* 전기 분해 : 이것은 전기를 사용하여 자발적인 화학 반응을 주도하는 과정입니다. 이 경우, 우리는 물 분자 (H2O)를 구성 요소로 나누고 있습니다.
* 음극 : 감소가 발생하는 음으로 하전 된 전극. 여기서 물 분자는 전자를 얻고 수소 가스로 감소됩니다.
2H2O + 2E- → H2 + 2OH-
* 양극 : 산화가 발생하는 양으로 하전 된 전극. 여기서 물 분자는 전자를 잃고 산소 가스로 산화됩니다.
2H2O → O2 + 4H + + 4E-
KNO3의 존재는 핵심 역할을합니다 :
* 전해질 : KNO3은 전해질로서 작용하여 용액을 통한 전류의 흐름을 허용한다. 그것 없이는 물이 전도도가 매우 낮고 전기 분해는 비효율적입니다.
* 부작용 없음 : 낮은 농도의 KNO3은 일차 반응이 물의 전기 분해임을 보장합니다. KNO3로부터의 질산염 이온 (NO3-)은 반응에 관여하지 않으며 용액에 남아있다.
따라서 전기 분해의 주요 생성물은 수소 가스 및 산소 가스입니다. 물 분해로 인해 농도가 약간 감소 할 수 있지만 KNO3은 물에 용해 된 상태로 남아 있습니다.