1. 가스 분자는 일정한 움직임입니다 :
- 고체 및 액체와 달리 가스 분자는 그 사이에 많은 공간이 있습니다.
- 그들은 끊임없는 임의의 움직임으로 서로 충돌하고 용기의 벽.
2. 충돌은 힘을 창출합니다 :
- 용기 벽과 가스 분자의 충돌은 작은 힘을 가합니다.
- 초당 수많은 충돌의 결합력으로 인해 눈에 띄는 압력이 생깁니다.
3. 압력은 단위 면적당 힘입니다 :
- 압력은 특정 영역에 가해지는 힘으로 정의됩니다.
- 컨테이너의 단위 면적당 충돌이 많을수록 압력이 높아집니다.
4. 압력에 영향을 미치는 요인 :
- 온도 : 온도가 높을수록 분자 이동이 더 빠른 것을 의미하여 더 빈번하고 강력한 충돌을 일으켜 압력이 높아집니다.
- 볼륨 : 컨테이너 부피가 작 으면 단위 면적당 더 많은 충돌이 발생하여 압력이 높아집니다.
- 분자 수 (가스 양) : 더 많은 분자는 더 많은 충돌을 의미하여 더 높은 압력을 초래합니다.
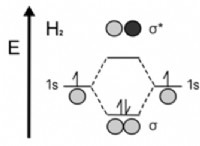
5. 이상적인 가스 법칙 :
- 압력, 부피, 온도 및 분자 수 사이의 관계는 이상적인 가스 법칙에 의해 설명됩니다.
* p * v =n * r * t
* 어디:
* p =압력
* V =볼륨
* n =가스 몰의 수
* r =이상적인 가스 상수
* t =온도
요약 : 가스의 압력은 분자가 용기 벽과 끊임없이 충돌하는 직접적인 결과입니다. 이러한 충돌의 빈도와 힘은 온도, 부피 및 존재하는 가스의 양과 같은 요인에 의해 영향을받습니다.