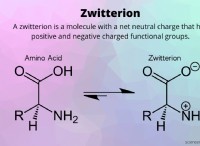
자유 에너지 다이어그램
* 자유 에너지 (G) : 세로 축은 시스템의 깁스 자유 에너지를 나타냅니다.
* 반응 진행 : 수평 축은 왼쪽의 반응물에서 오른쪽의 제품으로 이동하여 반응의 진행을 나타냅니다.
* 전이 상태 : 다이어그램의 피크는 반응 동안 가장 높은 에너지 지점 인 전이 상태를 나타냅니다.
* ΔG (자유 에너지 변화) : 반응물과 제품 간의 자유 에너지의 차이. 음성 ΔG는 제품 형성을 선호하는 자발적 반응을 나타냅니다. 양성 ΔG는 반응물 형성을 선호하는 자발적 반응을 나타냅니다.
반응물을 선호하는 시나리오
다음은 자유 에너지 다이어그램을 기반으로 평형 반응에서 더 많은 반응물의 형성을 선호하는 시나리오입니다.
1. 양성 ΔG (자유 에너지 변화) : 생성물의 자유 에너지가 반응물의 자유 에너지보다 높으면 (ΔG가 양수), 반응은 비 픽입니다. 이것은 시스템이 반응물을 선호한다는 것을 의미합니다.
2. 높은 활성화 에너지 : 매우 높은 활성화 에너지 (반응물과 전이 상태 사이의 에너지 차이)는 반응이 진행하기가 어렵습니다. 이것은 반응물에 유리한 전진 반응을 효과적으로 느리게한다.
3. 반응물과 제품 사이의 자유 에너지의 큰 차이 : ΔG가 음성 (유리한 제품)이더라도 반응물과 생성물 사이의 자유 에너지의 매우 큰 차이는 평형을 제품으로 강하게 이동시킬 것입니다. 이는 평형 상수 (k)가 매우 커질 것이며 반응물의 농도가 매우 낮다는 것을 의미합니다.
요약 :
* 양의 ΔG는 항상 반응물을 선호합니다.
* 높은 활성화 에너지는 전방 반응을 방해하여 반응물을 선호합니다.
* 반응물과 생성물 사이의 자유 에너지의 큰 차이는 음성이더라도 반응물 농도가 매우 낮을 수 있습니다.
예 :
+10 kJ/mol의 ΔG와의 반응을 고려하십시오. 이는 제품이 반응물보다 더 높은 자유 에너지를 가지고 있음을 의미합니다. 평형은 반응물의 측면에 크게 놓일 것입니다.
구체적인 예를 살펴 보거나 추가 질문이 있으시면 알려주십시오!