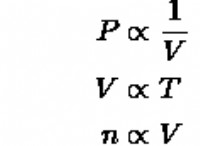* 질소의 전자 구성 : 질소에는 7 개의 전자가 있으며 구성 1S² 2S² 2P³가 있습니다. 이것은 가장 바깥 쪽 쉘에 5 개의 원자가 전자가 있음을 의미합니다 (2s² 2p³).
* 옥트 규칙 : 원자는 전자를 얻거나 분실하거나 공유하여 가장 바깥 쪽 쉘 (옥트 규칙)에 8 개의 전자를 갖는 안정적인 구성을 달성하는 경향이 있습니다.
* 질소 결합 : 질소는 3 개의 2p 전자를 공유함으로써 3 개의 공유 결합을 형성합니다. 각 결합은 질소에서 하나의 전자와 다른 원자에서 전자를 사용합니다.
* 고독한 쌍 : 질소에는 5 개의 원자가 전자가 있고 결합에 3 개만 사용하기 때문에 2 개의 전자가 남아 있습니다. 이 두 전자는 2P 궤도 중 하나에 위치한 고독한 쌍을 형성합니다.
이런 식으로 생각하십시오 :
* 질소는 행복하기를 원하며 외부 껍질에 8 개의 전자를 갖는 것이 행복한 곳입니다.
* 전자 중 3 개를 얻기 위해 3 개의 결합을 형성합니다.
* 여전히 두 개가 더 필요 하므로이 두 전자를 고독한 쌍으로 가깝게 유지합니다.
이 고독한 쌍은 질소의 반응성과 다양한 반응에 참여하는 능력에 영향을 미치기 때문에 중요합니다.