비등점 트렌드 이해
* 분자량 : 더 큰 분자는 일반적으로 전자가 많고 런던 분산 힘이 강하기 때문에 일반적으로 더 높은 비등점을 가지고 있습니다.
* 수소 결합 : 알코올은 강한 수소 결합을 형성하여 끓는점을 크게 증가시킬 수 있습니다.
* 분기 : 분자에서 분지는 표면적을 감소시켜 런던 분산 힘을 감소시키고 비등점을 낮 춥니 다.
분석하자
* 헥산 (C6H14) : 비등점이 69 ° C 인 비극성 알칸.
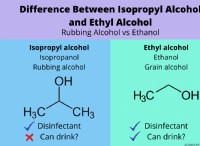
* 알코올 : 그들은 수소 결합이 가능한 -OH 그룹을 가지고있다.
알코올 비교
* 메탄올 (CH3OH) : 가장 작은 알코올, 낮은 끓는점.
* 에탄올 (C2H5OH) : 약간 더 크고 높은 비등점.
* 프로 파놀 (C3H7OH) : 더 크고 높은 비등점.
* 부탄올 (C4H9OH) : 더 큰 비등점.
답변
탄소 사슬 길이가 증가함에 따라 알코올의 끓는점이 증가합니다. 헥산은 비교적 작은 분자이므로 작은 알코올을 찾아야합니다.
에탄올 (C2H5OH) 끓는점은 78 ° C이며, 이는 헥산 (69 ° C)의 끓는점에 가장 가깝습니다.
중요한 참고 : 에탄올은 가장 가깝지만, 수소 결합이 헥산과 같은 비극성 알칸에 비해 알코올의 끓는점을 크게 증가 시킨다는 것을 기억하는 것이 여전히 중요합니다.