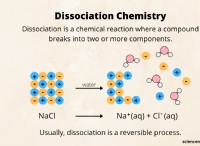
* 정규성 (n) 특정 종의 동등한 수에 기초하여 반응하는 용액에 사용되는 농도 단위이다.
* 에틸 아세테이트 (ch₃cooch₂ch₃) 에스테르입니다. 에스테르는 일반적으로 산이나 염기와 같은 특정 이온의 등가물을 생성하거나 소비하는 반응에 관여하지 않습니다.
따라서 정상의 개념은 에틸 아세테이트 용액에 적용되지 않습니다.
대신하고 싶은 일 :
* 특정 용매 (예 :물, 에탄올)에서 에틸 아세테이트 용액을 준비합니다. 농도를 중량/부피 백분율 (w/v) 또는 몰 (M)으로 표현합니다.
예 :
물에 에틸 아세테이트의 1% (w/v) 용액을 제조하려면 1 그램의 에틸 아세테이트를 100 ml의 물에 용해시킵니다. 0.1m 용액을 준비하려면 분자량 (88.11 g/mol)에 따라 필요한 에틸 아세테이트의 질량을 계산해야합니다.
중요한 참고 : 에틸 아세테이트는 물에 그다지 용해되지 않으므로 에탄올과 같은 다른 용매를 사용하여 더 높은 농도로 용액을 준비해야 할 수도 있습니다.
특정 응용 프로그램이있는 경우 더 많은 정보를 제공하고 적절한 준비 방법을 결정하는 데 도움을 줄 수 있습니다.