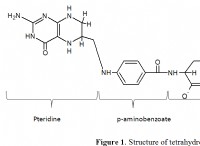
1. 구리 (II) 질산염의 공식을 결정하십시오 :
* 구리 (ii)는 +2 전하 (cu²⁺)를 갖는다.
* 질산염은 -1 전하 (NOI) 를가집니다.
* 전하의 균형을 맞추기 위해서는 모든 구리 (II) 이온에 대해 2 개의 질산염 이온이 필요합니다. 공식은 cu (no₃) ₂입니다.
2. 구리 (II) 질산염의 몰 질량을 계산하십시오 :
* Cu :63.55 g/mol
* N :14.01 g/mol (x2 두 개의 질소 원자가 있기 때문에 x2)
* O :16.00 g/mol (6 개의 산소 원자가 있기 때문에 x6)
* 어금니 질량 =63.55 + (14.01 x 2) + (16.00 x 6) =187.57 g/mol
3. 구리 (II) 질산염의 두더지 수를 계산하십시오 :
* 몰스 =질량 / 어금니 질량
* 몰스 =10.2 g / 187.57 g / mol =0.0544 mol
4. 질소 원자의 두더지 수를 계산하십시오 :
* 구리 (II) 질산염의 공식 단위 당 2 개의 질소 원자가 있기 때문에, 구리 (II) 질산염의 두 배의 질소 원자가있다.
* 질소의 두더지 =0.0544 mol Cu (NOIT) ₂ * 2 mol N / 1 mol Cu (NO₃) ₂ =0.1088 mol n
5. 질소 원자 수를 계산하십시오 :
* Avogadro의 숫자 (6.022 x 10²³ 원자/mol)를 사용하여 두더지를 원자로 변환하십시오.
* 질소 원자의 수 =0.1088 mol n * 6.022 x 10²³ 원자/mol =6.55 x 10²² 원자
따라서, 10.2g의 구리 (II) 질산염에 약 6.55 x 10²² 질소 원자가있다. .


![이번 토요일에 Mars Rover Launch Live를보십시오 [비디오 스트림]](/article/uploadfiles/202211/2022111014494262_S.jpg)