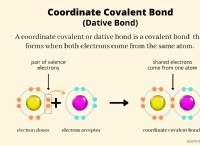
반응성 시리즈 이해
금속은 전자를 잃고 양성 이온을 형성하는 경향이 다양합니다. 이러한 경향은 반응성 시리즈로 표현되며, 이는 반응성 감소 순서대로 금속을 나열합니다.
* 높은 반응성 금속 : 이 금속은 전자를 쉽게 잃고 양의 이온을 형성합니다. 그들은 용액에서 덜 반응성 금속을 대체 할 수 있습니다.
* 반응성 금속이 적습니다 : 이 금속은 전자를 더 단단히 유지하고 이온을 형성 할 가능성이 적습니다.
반응
* 아연 및 구리 황산염 : 아연은 구리보다 반응성이 높습니다. 아연 금속이 구리 설페이트 용액에 배치 될 때 다음과 같은 반응이 발생합니다.
```
Zn (s) + cuso₄ (aq) → znso₄ (aq) + cu (s)
```
* 아연은 용액으로부터 구리를 대체하여 아연 황산염 (ZnSOA)과 구리 금속을 형성합니다.
* 아연에 쌓인 구리 금속은 특징적인 핑키 갈색 색상을 가지고 있습니다.
* 은 및 구리 황산염 : 은은 구리보다 덜 반응성입니다. 따라서,은을 구리 설페이트 용액에 배치 할 때 반응은 발생하지 않습니다.
* 은은 전자를 잃을 가능성이 적기 때문에 구리에서 구리를 대체 할 수 없습니다.
요약
아연과은 사이의 반응성의 차이는 반응이 발생하는지 여부를 결정합니다. 보다 반응성이 높으면 아연은 용액으로부터 구리를 대체하여 눈에 띄는 색상 변화를 초래합니다. 반응성이 떨어지는은은 황산 구리와 반응하지 않습니다.