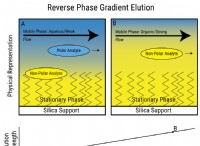
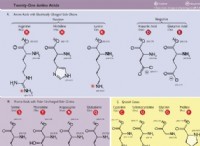
이유는 다음과 같습니다.
* 열역학의 첫 번째 법칙 : ΔU =Q + W.
* ΔU :시스템의 내부 에너지 변화
* Q :시스템에 추가 된 열
* W :시스템에서 수행 한 작업
* 가스 확장으로 수행 된 작업 : 가스가 일정한 압력에 대해 팽창하면 주변에서 작동합니다. 완료된 작업 (w)은 다음과 같이 계산됩니다.
* w =-pΔv
* P :일정한 압력
* ΔV :부피의 변화
중요한 메모 :
* 수행 된 작업은 부정적인 입니다 시스템 (가스)이 주변 환경에서 작업을 수행하고 있기 때문입니다.
* 열역학의 첫 번째 법칙에 따르면 내부 에너지의 변화는 by 의 작업을 뺀 열과 동일하다고합니다. 시스템.
* 가스가 압축되면 (볼륨 감소) 주변 환경이 시스템에서 작업을 수행함에 따라 작업이 긍정적입니다.
첫 번째 열역학 법칙의 모든 측면에 대해 더 명확하게 설명하려면 알려주십시오!