수소 결합
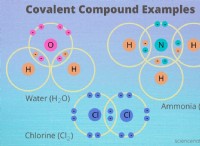
* 물 (h>o) : 물 분자는 서로 강한 수소 결합을 형성 할 수 있습니다. 수소 결합은 수소 원자가 이웃 분자의 고도로 전기 음성 원자 (산소)에 끌리는 분자간 힘 (분자 사이의 힘) 유형입니다. 이러한 채권은 상대적으로 강하고 파손하려면 상당한 양의 에너지가 필요합니다.
* 에탄 (c₂h₆) : 에탄 분자는 수소 결합보다 일시적이고 덜 강력한 반 데르 발스 세력만이 약한 반 데르 발스 힘을 경험합니다. 이 힘은 분자 내 전자 분포의 일시적 변동으로 인해 발생합니다.
결과
* 높은 비등 지점 : 물 분자 사이의 강한 수소 결합으로 인해 이러한 관광 명소를 극복하고 물이 액체에서 가스 (끓는)로 전환되도록하는 데 많은 에너지 (열)가 필요합니다. 이로 인해 100 ° C (212 ° F)의 높은 비등점이 발생합니다.
* 에탄의 끓는점 하부 : 에탄에서의 약한 반 데르 발스 힘은 극복하기가 더 쉬워서 -88.6 ° C (-127.5 ° F)의 비등점이 훨씬 낮습니다.
요약 : 물 분자들 사이의 강한 수소 결합의 존재는 에탄이 더 큰 분자이지만 물이 에탄보다 훨씬 높은 끓는점을 갖는 주된 이유입니다.