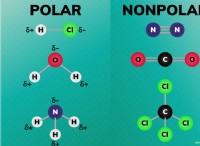
* CO2는 표준 온도 및 압력에서 가스입니다. 그것은 매우 높은 압력 하에서 액체 또는 고체로만 존재합니다.
* 승화 : 끓는 대신, CO2는 고체 (드라이 아이스)에서 *승화 지점 *이라고하는 특정 압력 및 온도에서 가스로 직접 전이합니다.
여기에 고장이 있습니다 :
* 승화점 : 표준 대기압 (1 atm)에서 -78.5 ° C (-109.3 ° F). 이 온도에서, 고체 CO2는 액체 상을 거치지 않고 직접 기체 CO2로 변할 것이다.
* 임계점 : 31.1 ° C (88 ° F) 및 73.8 bar (1,071 psi). 이 시점에서, CO2는 얼마나 많은 압력이 적용 되더라도 액화 될 수 없습니다.
그래서 "이산화탄소의 끓는 탄소"에 대해 이야기하는 대신, 우리는 그 승화 지점을 언급합니다.