다음은 고장입니다.
* 이산화황 (SO2) 및 질소 산화물 (NOX) 발전소, 공장 및 차량의 화석 연료 연소로 주로 대기로 방출됩니다.
* 대기에서,이 산화물은 수증기, 산소 및 기타 화학 물질과 반응하여 황산 (H2SO4) 및 질산 (HNO3)을 형성합니다. . 그런 다음이 산은 빗물에 용해되어 산성이됩니다.
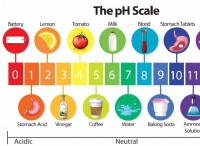
* 산성비는 정상 빗물보다 pH가 낮습니다 (pH는 약 5.6입니다) pH가 낮을수록 비가 더 산성이됩니다.
산성 비에는 몇 가지 유해한 영향이 있습니다.
* 숲과 작물의 손상 : 산성비는 토양을 더 산성으로 만들어 영양소를 침출하고 독성 금속을 방출함으로써 식물에 해를 끼칠 수 있습니다.
* 수역을 오염시킵니다 : 산성비는 호수와 강을 더 산성으로 만들어 물고기와 다른 수생 생물을 해칠 수 있습니다.
* 건물과 기념물이 침식 : 산성 비는 건물, 조각상 및 석재 또는 금속으로 만든 기타 구조물을 손상시킬 수 있습니다.
* 은 인간 건강에 영향을 미칩니다 : 산성비는 호흡기 시스템을 자극하고 다른 건강 문제에 기여할 수 있습니다.
산성비를 줄이려면 이산화황 및 질소 산화물의 방출을 줄여야합니다. 이것은 다음과 같이 달성 할 수 있습니다.
* 클리너 연료 사용 : 천연 가스 또는 재생 가능한 에너지 원으로 전환.
* 에너지 효율 향상 : 우리가 사용하는 에너지의 양을 줄입니다.
* 오염 제어 장치 설치 : 세정기 및 기타 기술을 사용하여 배출에서 이산화황 및 질소 산화물을 제거합니다.