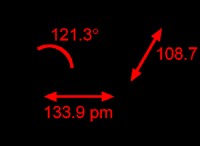
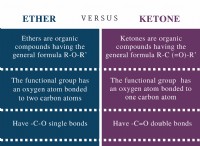
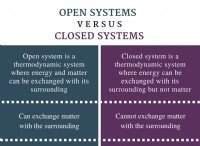
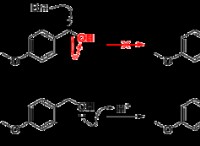
이유는 다음과 같습니다.
* 에너지는 NaCl에서 이온 결합을 깨기 위해 필요합니다 : 결정 격자에서 양으로 하전 된 나트륨 이온 (Na+)과 음으로 하전 된 클로라이드 이온 (Cl-) 사이의 강한 정전기 인력은 극복하기 위해 에너지가 필요하다.
물 분자를 분리하려면 * 에너지가 필요합니다. 수소 결합을 통해 물 분자가 서로 끌어옵니다. 이러한 채권을 깨는 데는 에너지가 필요합니다.
* 에너지는 이온 다이폴 상호 작용의 형성에 의해 방출됩니다. 일단 NaCl이 용해되면, 물 분자는 이온을 둘러싸고 이온 다이폴 상호 작용을 형성한다. 이것은 에너지를 방출하지만 초기 채권을 깨는 데 필요한 에너지를 보상하는 것만으로는 충분하지 않습니다.
전반적으로, 새로운 결합을 형성하는 데 방출되는 것보다 결합을 깨뜨리는 데 더 많은 에너지가 필요하여 순 에너지 입력과 흡열 반응이 발생합니다. . 그렇기 때문에 물에 소금을 녹일 때 약간의 냉각 효과가 느껴질 수 있습니다.