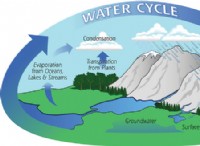
1. 원자가 전자 수
* 탄소 (C) :4 개의 원자가 전자 각각 * 2 =8 전자
* 수소 (H) :1 원자가 전자 각각 * 2 =2 전자
* 산소 (O) :6 원자가 전자
총 원자가 전자 :8 + 2 + 6 =16 전자
2. 중앙 원자를 결정하십시오
* 탄소는 가장 전기 음성 원자이므로 중심 원자 일 가능성이 높습니다.
3. 원자를 단일 결합으로 연결하십시오
* 두 탄소를 단일 채권으로 연결하십시오.
* 각 탄소를 수소 원자에 연결하십시오.
* 하나의 탄소를 산소 원자에 연결하십시오.
4. 남은 전자를 분배하십시오
* 지금까지 8 개의 전자 (4 개의 단일 본드)를 사용했습니다.
* 나머지 8 개의 전자는 옥트 규칙을 만족시키기 위해 분포되어야합니다 (2 만 필요한 수소를 제외하고 각 원자 주위의 8 개의 전자).
5. Octet Rule을 확인하십시오
* 각 수소에는 2 개의 전자 (전체 쉘)가 있습니다.
* 1 개의 탄소에는 6 개의 전자가 있습니다 (2 개 더 필요).
* 다른 탄소에는 6 개의 전자가 있습니다 (2 개 더 필요).
* 산소에는 6 개의 전자가 있습니다 (2 개 더 필요).
6. 이중 채권을 형성합니다
* Octet 규칙을 충족시키기 위해서는 이중 결합을 형성해야합니다. 산소 원자에는 2 개의 전자가 필요하며 각 탄소에는 2 개의 전자가 필요합니다.
* 산소와 탄소 중 하나 사이의 이중 결합은 3 개의 원자 모두에 대한 옥셋을 만족시킬 것입니다.
최종 루이스 구조
```
시간
|
C =C =O
|
시간
```
중요한 참고 : 케텐은 반응성 분자이며 탄소와 산소 사이의 이중 결합과 두 탄소 원자 사이의 이중 결합을 갖는 독특한 구조를 갖는다.