황의 화학적 특성 :
유황은 다양한 산업에서 다재다능한 구성 요소를 만드는 독특한 화학적 특성 세트를 가진 매혹적인 요소입니다. 다음은 고장입니다.
1. 전기 음성 :
* 황은 비 금속 입니다 전기 음성이 2.58. 이것은 화학 결합에서 전자를 유치하는 경향이 강한 것을 의미합니다.
* 전기성은 산소 (3.44)와 염소 (3.16) 사이에있어 다양한 원소와 극성 공유 결합을 형성 할 수 있습니다.
2. 산화 상태 :
* 황은 -2 내지 +6 범위의 다양한 산화 상태를 나타낼 수 있습니다. .
*이 다목적 성은 황화가 광범위한 화학 반응에 참여하고 다양한 화합물을 형성 할 수있게합니다.
* 일반적인 산화 상태는 다음과 같습니다.
* -2 : 황화물 (예 :h₂s, fes)에서
* +4 : 이산화황에서 (So₂)
* +6 : 황산에서 (HASSO₄)
3. 반응성 :
* 금속과의 반응성 : 황은 대부분의 금속과 쉽게 반응하여 황화물 를 형성합니다 .
* 이것은 광업 및 야금 산업에서 중요한 반응입니다.
* 비금속과의 반응성 : 황은 또한 산소, 할로겐 및 질소와 같은 비금속과 반응하여 다양한 화합물을 형성합니다.
* 예로는 이산화황 (SO₂), 트라이 산화 황 (SO₃) 및 황 6 헥사 플루오 라이드 (SF₆)가 있습니다.
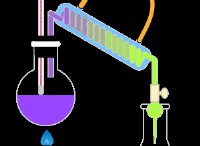
* 산소와의 반응성 : 유황 화상은 공기 중에 이산화황 (So₂) 가스를 생산하기 위해 공기 중에 화상을 입 힙니다 산성비 형성을 담당합니다.
*이 반응은 황산의 생산에 중요합니다.
4. 산 형성 :
* 황은 강산을 형성합니다 비료 생산, 배터리 제조 및 정제 공정을 포함한 수많은 응용 분야에 사용되는 중요한 산업 화학 물질 인 황산 (HASOA)과 마찬가지로.
* 황산 (H₂SOA) 및 티오 설 푸르 산 (HASS₂OA)과 같은 다른 황 함유 산도 알려져 있습니다.
5. 동반 로프 :
* 황은 allotropy 를 나타냅니다 , 그것은 다양한 물리적 특성을 가진 다른 구조적 형태로 존재한다는 것을 의미합니다.
* 가장 흔한 할당량은 마름모꼴 황입니다 , 노란색, 부서지기 쉬우 며 결정입니다.
* 다른 동화물에는 monoclinic sulfur 가 포함됩니다 및 플라스틱 황 , 각각 뚜렷한 특성을 가진.
6. 생물학적 중요성 :
* 황은 생명의 필수 요소입니다. 그것은 아미노산 (시스테인 및 메티오닌), 단백질 및 비타민과 같은 많은 생물학적 분자의 구성 요소입니다.
* 효소 촉매, 해독 및 면역계 기능과 같은 다양한 생물학적 과정에서 중요한 역할을합니다.
7. 환경 영향 :
* 산업 공정의 이산화황 (SO₂) 배출은 산성 비 에 크게 기여합니다. 생태계와 인프라를 손상시킬 수 있습니다.
그러나 황은 탈황 과정에서도 사용됩니다 연료에서 황을 제거하고 배출을 줄입니다.
8. 산업 응용 분야 :
* 황은 다음을 포함하여 다양한 산업 분야에서 사용됩니다.
* 비료 생산 (황산으로)
* 석유 정제
* 종이 제조
* 고무 vulcanization
* 제약
* 폭발물
* 안료
황의 화학적 특성을 이해하는 것은 다양한 분야에서 책임을 져야합니다. 다목적 성을 활용하여 잠재적 인 환경 영향을 최소화하면서 이점을 활용할 수 있습니다.