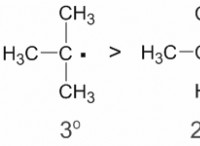
1. 형성된 이온을 결정하십시오 :
황산 칼륨 (k₂so₄)이 물에 용해되면 이온으로 분리됩니다.
k₂so₂ (aq) → 2k⁺ (aq) + so₄²⁻ (aq)
2. 각 이온의 두더지를 계산하십시오 :
* 칼륨 이온 (k⁺) : 1 몰마다 2 몰의 k⁺ 이온이 있으므로 2.6 몰 k ₂소 ₄ * 2 몰 k k k k k₂so₄ = 5.2 몰 k 가 있습니다.
* 설페이트 이온 (So₄²⁻) : 1 몰마다 1 몰의 so₄²⁻ 이온이 있으므로 2.6 몰 k ₂소 ₄ * 1 몰 So₄²⁻/mole k₂ so₄ = 2.6 moles so₄²⁻ 가 있습니다.
3. 이온의 총 두더지 :
각 이온의 두더지를 추가하십시오 :5.2 몰 + + 2.6 몰 so₄²⁻ = 7.8 몰의 이온 .
따라서 2.6 몰의 k₂so₄에는 7.8 몰의 이온이 있습니다.