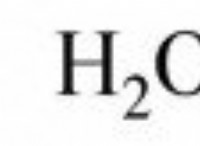이유는 다음과 같습니다.
* 물에서 : 황화수소가 물에 용해되면, 수소 설파이드 이온 (HS⁻) 및 하이드로 늄 이온 (HATO)을 형성하기 위해 양성자 (HAT)를 기증합니다. 이 과정은 용액에서 HAT 이온의 농도를 증가시켜 산성으로 만듭니다.
반응 :
h₂s (aq) + h₂o (l) ⇌ hs⁻ (aq) + h₃o⁺ (aq)
* ka 값 : 황화수소의 산도 상수 (ka)는 매우 작으며 (약 10), 이는 그것이 약산임을 나타냅니다. 그러나 양성자를 기증 할 수 있기 때문에 여전히 산성입니다.
황화수소의 산도는 염산과 같은 강한 산 (HCL)보다 유의하게 약하다는 점에 유의해야합니다.