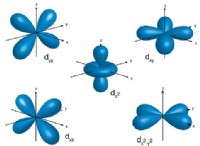
금속 결합
* 전자 "바다": 전자는 특정 원자에 단단히 결합되지 않습니다. 대신, 이들은 금속 격자 전체에서 자유롭게 움직이는 비편성 전자의 "바다"를 형성합니다.
* 고정 위치 없음 : 이 전자는 특정 원자와 관련이 없으므로 위치를 예측할 수 없습니다.
* 높은 전도도 : 전자의 자유로운 움직임은 금속의 높은 전기 및 열전도율을 설명합니다.
이온 결합
* 전자의 전달 : 하나의 원자 (일반적으로 금속)는 하나 이상의 전자를 잃어서 양으로 하전 된 이온 (양이온)이되는 반면, 다른 원자 (일반적으로 비금속)는 전자를 얻기 위해 음으로 하전 된 이온 (음이온)이됩니다.
* 정전기 적합성 : 반대로 하전 된 이온은 강한 정전기력에 의해 함께 유지된다.
* 고정 위치 : 이온은 결정 격자 내에서 고정 된 반복 패턴으로 배열되어 위치를 예측할 수있게한다.
공유 결합
* 전자 공유 : 둘 이상의 원자는 전자를 공유하여 안정적인 전자 구성을 달성합니다.
* 국소 전자 : 공유 전자는 결합 된 원자 사이에 국한되어 공유 결합을 형성한다.
* 고정 위치 : 공유 전자는 결합 내에 국한되어 있으며, 이들의 위치는 금속 결합보다 더 예측 가능하지만 이온 결합에서는 고정되지 않았다.
요약 테이블
| 채권 유형 | 전자 위치 | 주요 기능 |
| --- | --- | --- |
| 금속 | 비편성, 자유로운 움직이는 "바다"| 높은 전도도, 가단성, 연성 |
| 이온 | 특정 이온 주위에 전달 및 고정 | 높은 용융점, 취성 |
| 공유 | 원자 사이에서 공유 및 국소화 | 가변 융점, 종종 가스 또는 액체 |
주요 차이점 :
* 금속 결합 : 자유롭게 움직이는 전자, 고정 위치 없음.
* 이온 결합 : 전자는 전달되어 특정 이온에 고정된다.
* 공유 결합 : 전자는 특정 원자 사이에서 공유되고 국한됩니다.
전자 위치의 이러한 근본적인 차이는 금속, 이온 성 화합물 및 공유 화합물의 뚜렷한 특성을 초래합니다.