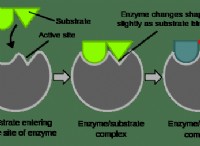
* 하위 스크립트는 분자의 조성을 나타냅니다 : 화학적 공식의 첨자는 분자 내의 각 요소의 원자 수를 나타냅니다. 예를 들어, H, HATE는 2 개의 수소 원자와 하나의 산소 원자를 함유하는 하나의 물 분자를 나타냅니다. 이러한 첨자를 변경하면 분자 자체의 화학적 동일성이 변경됩니다.
* 밸런싱에는 계수가 포함됩니다. 화학 방정식의 균형은 계수 를 조정해야합니다 각 분자 앞에서. 계수는 반응에 참여하는 분자의 수를 나타냅니다. 계수를 변경하면 화학 공식을 변경하지 않고 방정식의 양쪽에 각 요소의 원자 수를 조정합니다.
예 :
불균형 방정식 : h₂ + o→ → h₂o
균형 방정식 : 2H→ + o → 2H₂O
이 예에서, 우리는 h₂ ~ 2의 계수와 h₂o 앞의 계수를 2 ~ 2로 조정했습니다. 이는 방정식의 양쪽에 동일한 수의 수소와 산소 원자가 (4 개의 수소 원자와 2 개의 산소 원자)를 갖도록합니다. 화학 공식 (h₂ 및 o₂) 내의 첨자는 변경되지 않은 상태로 유지되었습니다.
구역 변경은 완전히 다른 화학 반응을 일으켜 프로세스의 잘못된 표현으로 이어집니다.