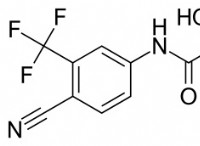
이유는 다음과 같습니다.
* 이온 성 화합물은 반대로 하전 된 이온 사이의 정전기 인력에 의해 형성됩니다. 이 이온은 일반적으로 금속 (양이온) 및 비금속 (음이온)입니다.
* 중립을 달성하기 위해 양이온의 총 양전하는 음이온의 총 음전하와 동일해야합니다.
* 구독은 공식 장치에 각 이온 중 몇 개가 존재하는지 알려줍니다. 이것은 요금이 균형을 유지하도록합니다.
예 :
* NaCl (염화나트륨)
* 나트륨 (NA)은 +1 전하 (NA태)에 있습니다.
* 염소 (CL)는 -1 전하 (CL⁻)에 있습니다.
* 요금은 동일하고 반대이므로 각 이온 중 하나만 필요합니다. 공식은 단순히 NaCl입니다.
* mgcl> (염화 마그네슘)
* 마그네슘 (mg)은 +2 충전 (mg²⁺)이 있습니다.
* 염소 (CL)는 -1 전하 (CL⁻)에 있습니다.
* 전하의 균형을 맞추기 위해서는 마그네슘 이온의 +2 전하와 동일하게 두 개의 클로라이드 이온 (2 x -1 =-2)이 필요합니다. 공식은 mgcl is입니다.
키 포인트 :
* 구독은 항상 정수로 작성됩니다.
* 첨자가 1 인 경우 , 그것은 일반적으로 생략됩니다.
* 최대 가능한 정수 비율 이온은 화합물을 나타내는 데 사용됩니다.
이진 이온 성 화합물에 대한 공식을 올바르게 작성하고 해석하는 데 첨자를 이해하는 것이 중요합니다.