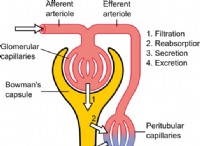
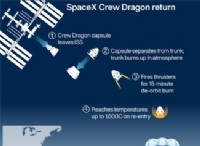
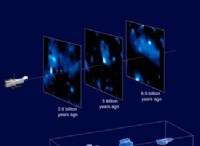
고장은 다음과 같습니다.
* 공동 속성 : 끓는점 고도는 공동 특성으로, 이는 특정 정체성이 아닌 용액의 용질 입자의 수에 따라 다릅니다.
* 해리 : 이온 성 화합물이 물에 용해되면 구성 이온에 분리됩니다. 예를 들어, NaCl은 Na+ 및 클리온에 용해됩니다.
* 더 많은 입자, 더 높은 비등점 : 용액에 이온이 많을수록 용질 입자의 수가 더 많습니다. 이 증가 된 입자 농도는 용매의 증기압을 방해합니다 (이 경우 물). 용매 분자는 증기 상으로 빠져 나가려면 더 많은 에너지가 필요하므로 더 높은 비등점이 생깁니다.
* Van't Hoff Factor : 공식 단위 당 생성 된 이온의 수는 Van't Hoff 계수 (I)로 표시됩니다. 예를 들어, NaCl은 i =2이고 CaCl2는 i =3 을가집니다. 반도 호프 팩터가 높을수록 비등점 높이가 커집니다.
요약 :
* 더 용해 된 이온 =더 많은 용질 입자 =더 높은 끓는점.
이 효과는 다음과 같은 다양한 응용 분야에서 솔루션의 행동을 이해하는 데 중요합니다.
* 동결 지점 우울증 : 용질의 첨가는 또한 용액의 동결 지점을 낮추게한다.
* 삼투압 : 반투과성 막을 가로 지르는 용매의 흐름을 방지하는 데 필요한 압력.
* 바닷물 솔루션 : 바닷물의 높은 끓는점은 담수보다 끓는 데 시간이 오래 걸리는 이유입니다.