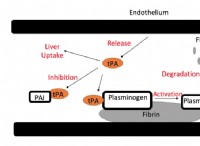
1. 수소 결합 : 메탄올은 산소 원자에 직접 결합 된 수소 원자의 존재로 인해 수소 결합을 형성 할 수있다. 아세톤은 산소 원자를 갖는 동안 수소가 직접 부착되어 있지 않아 수소 결합에 참여하는 것을 방지합니다.
2. 분자간 힘 : 수소 결합은 아세톤에 존재하는 쌍극자 쌍극자 상호 작용과 비교하여 강한 분자간 힘이다. 더 강한 분자간 힘은 극복하기 위해 더 많은 에너지가 필요하여 더 높은 끓는점을 초래합니다.
3. 분자 모양과 극성 : 메탄올은 메탄올의 산소 원자 주위에 더 국소화 된 전자 밀도로 인해 아세톤보다 더 극성이다. 이것은 쌍극자 쌍극자 상호 작용을 향상시켜 더 높은 비등점에 더 기여합니다.
4. 분자량 : 분자량의 차이는 유의하지 않지만, 메탄올 (32 g/mol)은 아세톤 (58 g/mol)보다 약간 무겁다. 이것은 메탄올의 약간 더 강한 런던 분산 힘에 기여하며, 이는 또한 끓는점을 결정하는 데 역할을합니다.
요약 : 구조적 특징으로 인해 메탄올에 존재하는 더 강한 수소 결합은 더 강한 분자간 상호 작용을 초래하여, 더 많은 에너지가 극복하고 아세톤에 비해 더 높은 끓는점을 초래한다.