이해를 돕기 위해 Engthalpy of Formation의 개념을 세분화합시다 :.
형성의 엔탈피 (ΔHF °)
* 정의 : 하나의 혼자서 화합물이 표준 상태의 구성 요소로부터 형성 될 때 발생하는 엔탈피 변화 (일정한 압력에서의 열 변화).
* 표준 상태 : 이것은 일반적으로 298k (25 ° C) 및 1 ATM 압력으로 정의됩니다.
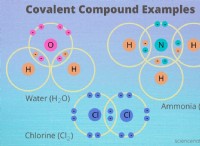
* 예 : 물 형성 엔탈피 (HATER)는 -285.8 kJ/mol이다. 이는 표준 조건에서 1 몰의 액체 물이 원소 (수소 가스, HA 및 산소 가스, O₂)로부터 형성되면 285.8 kJ의 열이 방출됨을 의미합니다 (음수 부호는 열이 방출됨).
engthalpy of formation을 와 비교하는 것은 무엇입니까?
비교하려는 다른 용어를 제공하면보다 구체적인 답변을 제공 할 수 있습니다.
예를 들어, 당신은 다음에 대해 묻습니다.
* 연소의 엔탈피 : 물질의 한 몰이 산소에서 완전히 연소 될 때 발생하는 엔탈피 변화.
* 반응의 엔탈피 : 화학 반응 중에 발생하는 엔탈피 변화.
* 본드 엔탈피 : 기체 분자에서 특정 유형의 결합의 1 몰을 파괴하는 데 필요한 평균 엔탈피 변화.
비교에 관심이있는 것을 알려 주시면 차이점을 설명해 드리겠습니다.