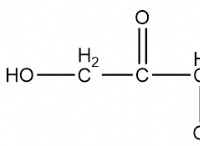
다음은 고장입니다.
* pH : 용액에서 수소 이온 농도 ([H+])의 척도.
* 산 : 물에 용해 될 때 수소 이온 (H+)을 방출하는 물질, 낮은 pH 를 초래합니다. (일반적으로 7 미만).
* 베이스 : 물에 용해 될 때 수소 이온 (H+)을 받아들이는 물질, 더 높은 pH 를 초래합니다. (일반적으로 7 이상).
키 포인트 :
* pH 척도는 0에서 14 사이입니다.
* 7의 pH는 중성이다 (산성이거나 염기성이 아님).
* pH가 낮을수록 산이 강해집니다.
* pH가 높을수록베이스가 강해집니다.
예를 들어:
* 염산 (HCl) pH는 0이므로 매우 강한 산으로 만듭니다.
* 수산화 나트륨 (NAOH) pH는 14 명으로 매우 강력합니다.
* 순수한 물 pH는 7입니다.
참고 : pH 척도는 편리하지만 로그 척도라는 것을 기억하는 것이 중요합니다. 이것은 하나의 pH 단위의 변화가 수소 이온 농도의 10 배 변화를 나타낸다는 것을 의미한다.