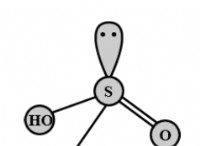
1. 원자가 전자 수 :
* 탄소 (C)에는 4 개의 원자가 전자가 있습니다.
* 수소 (H)는 각각 1 개의 원자가 전자 (총 2 개)를 갖는다.
* 염소 (CL)에는 각각 7 개의 원자가 전자 (총 14 개)가 있습니다.
총 원자가 전자 =4 + 2 + 14 =20
2. 중앙 원자를 결정하십시오 :
* 탄소는 전기 음성 원자가 가장 적기 때문에 중심 원자가 될 것입니다.
3. 원자를 단일 결합으로 연결하십시오.
* 탄소 원자를 단일 결합으로 2 개의 수소 원자와 2 개의 염소 원자에 연결하십시오. 이것은 8 개의 원자가 전자 (4 개의 결합 * 2 전자/결합)를 사용합니다.
4. 나머지 전자 분배 :
* 12 개의 원자가 전자가 남아 있습니다 (총 20 개 -8 사용).
* 각 염소 원자는 옥셋을 완성하기 위해 6 개의 전자가 더 필요합니다.
* 각 염소 원자 주위에 3 개의 고독한 쌍 (6 개의 전자)을 놓습니다.
5. 옥트 규칙을 확인하십시오 :
* 탄소는 주위에 8 개의 전자 (4 개의 결합 * 2 개의 전자/결합)를 가지고 있으며 옥트 규칙을 충족합니다.
* 각 수소 원자에는 2 개의 전자가 있으며, 이는 안정적인 구성입니다.
* 각 염소 원자에는 주변에 8 개의 전자 (1 개의 결합 + 3 론 쌍)가있어 옥트 규칙을 충족합니다.
루이스 구조 :
```
시간
|
H -C -CL
|
cl
```
키 포인트 :
* 구조는 전체 옥셋을 갖는 모든 원자를 보여줍니다 (듀엣이있는 수소 제외).
* 중심 탄소 원자에는 4 개의 결합이 있으며, 이는 전형적인 결합 거동입니다.
* 루이스 구조는 분자의 모양과 특성을 담당하는 전자의 결합 및 고독한 쌍을 나타냅니다.