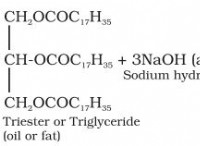붕사 표준화에서 HCL의 몰라리와 계수 계산
붕사를 사용하여 HCL 용액을 표준화하면 (나트륨 사면 테트라 워싱 탈 카이드 레이트, Na₂b₄o₇ · 10h₂o)는 적정 반응을 포함한다. HCL 솔루션의 몰라도와 인자를 계산하는 방법은 다음과 같습니다.
1. 반응 화학량 론 :
HCL과 붕사 사이의 반응은 다음과 같습니다.
```
na₂b₂o₇ · 10h₂o + 2 HCl → 4 b (OH) ₃ + 2 NaCl + 5 H₂O
```
2. 적정 절차 :
* 무게가 정확하게 알려진 붕사 (M)의 덩어리로 물에 녹입니다.
* 적정 종말점까지 HCL 용액을 갖는 붕사 (일반적으로 적절한 표시기를 사용하여 색상 변화로 표시).
* 레코드 사용 된 HCL의 부피 (V).
3. 계산 :
* 붕사의 두부 계산 :
* 붕사의 몰 질량 (na₂b₄o₇ · 10h₂o) =381.37 g/mol
* 붕사 (n) =질량 (m) / 어금니 질량의 두더지
* HCl의 두더지 계산 :
* 균형 방정식에서, 1 몰의 붕사는 2 몰의 HCl과 반응합니다.
* HCl의 두더지 =2 * 붕사 몰
* HCl의 몰토리를 계산합니다.
* Molarity (M) =리터에서 HCl (v)의 HCl의 두더지.
* HCl의 계수를 계산합니다 :
* 계수 (f) =몰토리티 (m) / HCl의 이론적 몰토리.
* 이론적 어금니는 솔루션에서 목표로하는 몰토리입니다.
예 :
무게가 0.500g의 붕사를 말하고 25.00 mL의 HCL 용액으로 적정한다고 가정 해 봅시다.
* 붕사의 두더지 : n =0.500 g / 381.37 g / mol =0.00131 mol
* HCl의 두더지 : 2 * 0.00131 mol =0.00262 mol
* HCl의 몰토리성 : M =0.00262 mol / 0.025 l =0.105 m
* Hcl의 계수 : 이론적 혼잡성이 0.100m라고 가정하면 계수는 0.105 m / 0.100 m =1.05입니다.
중요한 메모 :
* 적정의 끝점은 날카 롭고 재현 가능해야합니다.
* 신뢰할 수있는 분석 균형을 사용하여 붕사를 정확하게 평가하십시오.
* 적정 전에 붕사가 완전히 용해되도록하십시오.
* 적정에 적합한 지표를 사용하십시오.
* 정확성과 일관성을 보장하기 위해 적어도 3 번 적정을 반복하십시오.
이 단계를 수행함으로써 붕사 표준화를 사용하여 HCL 솔루션의 몰계와 인자를 정확하게 결정할 수 있습니다. 이 정보는 다양한 분석 및 실험 응용 분야에 중요합니다.