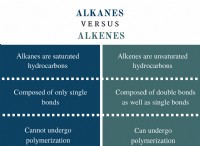
* 탄수화물의 일반적인 공식은 (ch₂o) n. 입니다 이것은 모든 탄소 원자에 대해 2 개의 수소 원자와 하나의 산소 원자가 있습니다. 이 비율은 포도당 (c₆h₁₂o₆)과 같은 간단한 설탕과 전분과 같은 더 복잡한 탄수화물에 대해 적용됩니다.
* 이 비율은 절대적이지 않습니다. DNA의 데 옥시 리보스 (c₅h₁₀o₄)와 같은 일부 탄수화물은 산소 원자가 없기 때문에이 비율에서 약간 벗어난다. 그러나 2 :1 비율은 좋은 일반 가이드 라인입니다.
이 비율이 중요한 이유는 다음과 같습니다.
* 물 형성 : 탄수화물이 분해되면 물을 방출합니다. 탄수화물로부터의 수소 및 산소 원자는 결합되어 H₂O를 형성한다.
* 에너지 저장 : 이 일관된 비율은 탄수화물이 살아있는 유기체의 주요 에너지 원인 이유를 설명하는 데 도움이됩니다. 호흡을 통해 방출 될 수있는 탄소, 수소 및 산소 저장 에너지 사이의 결합.
이 비율은 단순화라는 것을 기억해야합니다. 탄수화물의 실제 구조 및 조성은 특정 유형의 탄수화물에 따라 더 복잡하고 다양합니다.