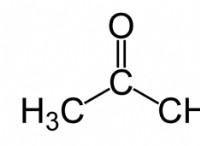
SCL6 (황 육류화수소) :
* 모양 : SCL6은 팔면체 모양을 갖는다. 이것은 6 개의 염소 원자가 중심 황 원자 주위에 대칭 적으로 배열된다는 것을 의미합니다.
* 극성 : 이 대칭 배열로 인해 각 S-Cl 결합의 쌍극자 모멘트는 서로를 취소합니다. 분자에는 순 쌍극자 모멘트가 없으므로 nonpolar 로 만듭니다. .
SCL4 (황화물) :
* 모양 : SCL4는 시소 (또는 왜곡 된 사면체) 모양을 갖는다. 이것은 4 개의 염소 원자가 황 원자 주위에 대칭 적으로 배열되지 않음을 의미합니다.
* 극성 : 염소 원자의 고르지 않은 배열은 전자 밀도의 고르지 않은 분포를 초래한다. S-CL 결합의 쌍극자 모멘트는 서로를 취소하지 않습니다. 이것은 순 쌍극자 모멘트를 만듭니다 분자의 경우 Polar 를 만듭니다 .
요약 : 극성의 차이는 분자 형상에서 발생합니다. SCL6의 대칭 팔면체 형태는 결합 쌍극자의 취소를 초래하는 반면, SCL4의 비대칭 시소 모양은 순 쌍극자 모멘트로 이어진다.