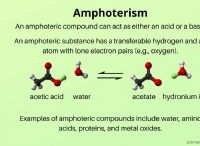
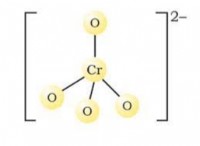
이온 성 화합물
* 용해 과정 : 이온 성 화합물은 해리 라는 과정을 통해 용해됩니다 . 이온 성 화합물이 물에 배치되면 극성 물 분자는 이온을 둘러싸고 결정 격자와 효과적으로 당기는 것입니다. 물 분자 (수소)의 양의 끝은 음이온 (음이온)에 끌리는 반면, 음성 말단 (산소)은 양의 이온 (양이온)에 끌린다. 이 매력은 이온을 고체 상태에서 함께 고정하는 정전기력을 극복합니다.
* 결과 : 이온은 물 분자 (수화)로 둘러싸여 있으며 용액 전체에 분산됩니다. 용액은 전해질이되어 자유 이온의 존재로 인해 전기를 전도 할 수 있습니다.
* 예 : 테이블 소금 (NaCl), 염화 칼륨 (KCl), 수산화 나트륨 (NAOH)
공유 화합물
* 용해 과정 : 공유 화합물은 용 매화 라는 공정을 통해 용해됩니다 . 공유 화합물의 분자는 일반적으로 수소 결합 를 통해 용매 분자와 상호 작용합니다. 또는 쌍극자 쌍극자 상호 작용 .
* 결과 : 공유 화합물 분자는 용매 분자로 둘러싸여 있지만 반드시 개별 이온으로 분리되는 것은 아닙니다. 용액은 공유 화합물 자체가 용액에서 이온화 여부에 따라 전해질 일 수 있거나 아닐 수있다.
* 예 : 당 (자당), 에탄올 (C2H5OH), 이산화탄소 (CO2)
간단히의 주요 차이점 :
* 이온 형성 : 이온 성 화합물은 이온으로 분리하여 용해되는 반면, 공유 화합물은 일반적으로 분자로 손상되지 않습니다.
* 전해질 거동 : 이온성 용액은 전해질 (전기 전기)이고, 공유 용액은 전해질이 될 수 있거나 아닐 수도 있습니다.
* 매력 : 이온 용해는 이온과 물 분자 사이의 강한 정전기력을 포함한다. 공유 용해는 수소 결합 또는 쌍극자-쌍극자 상호 작용과 같은 약한 힘을 포함합니다.
중요한 참고 : 일부 공유 화합물은 극성 공유 로 간주 될 수 있습니다 부분 요금으로 인해 물에 용해 될 수 있습니다. 이 분자는 물과 수소 결합을 형성 할 수 있지만 이온으로 완전히 분리되지는 않습니다.