이유는 다음과 같습니다.
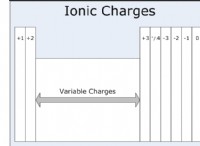
* 이온화 에너지 (IE) : 접지 상태의 기체 원자 또는 이온에서 전자를 제거하는 데 필요한 에너지. Cl-와 같은 모노 애니온의 경우, 즉, 중성 원자를 형성하기 위해 전자를 제거하는 데 필요한 에너지를 나타냅니다.
* 전자 친화력 (EA) : 전자가 접지 상태의 중성 기체 원자에 첨가 될 때 에너지의 변화. CL과 같은 중성 원자의 경우, EA는 음이온이되기 위해 전자를 얻을 때 방출 된 에너지를 나타냅니다.
핵심 요점은 두 프로세스 모두 요소의 전자 구성에서 동일한 변화를 포함한다는 것입니다.
* cl- :의 이온화 Cl- (1S²2S²2P⁶3S²3P⁶) → Cl (1S²2S²2P⁶3S²3P⁵) + EA
* cl의 전자 친화력 : Cl (1S²2S²2P⁶3S²3P⁵) + EAT → CL- (1S²2S²2P⁶3S²3P⁶)
따라서, Cl- (예 :Cl-의)에서 전자를 제거하는 데 필요한 에너지는 크기가 같지만 전자가 Cl (Cl)에 첨가 될 때 방출 된 에너지와의 반대쪽이지만 .
간단히 말해서, 음으로 하전 된 이온으로부터 전자를 빼앗기 위해 필요한 에너지는 전자가 중성 원자에 첨가 될 때 방출 된 에너지와 동일하다. .