주요 차이 - 화합물 대 혼합물
화합물은 화학적으로 결합 된 다른 종류의 원자로 구성됩니다. 혼합물은 물리적으로 섞인 두 가지 이상의 다른 종류의 물질 (원자, 분자 또는 화합물)으로 구성됩니다. 화합물과 혼합물의 주요 차이점은 화합물이 화학적으로 결합되는 반면 혼합물은 그렇지 않다는 것입니다.
이 기사는
에 대해 설명합니다 1. 화합물이란 무엇입니까?
- 정의, 특성, 결합 유형, 예
2. 혼합물이란 무엇입니까?
- 정의, 특성, 예
3. 화합물과 혼합물의 차이점은 무엇입니까? 
화합물이란 무엇입니까 - 정의, 특성, 결합 유형, 예
화합물은 요소로 만들어집니다. 특정 화합물은 화학적으로 결합 된 둘 이상의 원소로 구성됩니다. 화합물은 그들이 구성된 요소와 완전히 다를 수 있습니다. 예를 들어, Na는 고도로 반응성 금속이고 Cl 2 입니다. 독성 가스입니다. 그러나 NaCl은 요리에 사용되는 소금입니다. 또 다른 훌륭한 예는 h 2 로 구성된 물입니다. 및 o 2 . 물은 두 성분이 가스 임에도 불구하고 액체입니다.
특정 화합물에서 원자의 함량의 비율은 일정하게 유지되며 특정 화합물에 고유합니다. 비율이 다르면 새로운 화합물이 발생합니다. 이 시나리오는 다음 예제에 의해 자세히 설명되어 있습니다.
질소와 산소는이 두 화합물을 발생시킵니다.
n 2 (g) + o 2 (g) → 2no (g) 산화 질소 또는 질소 산화 질소
2No (g) + o 2 (g) → 2NO 2 (g) 아산화 질소 또는 이산화 질소
질소 산화 질소와 아질산 이산화 질소는 동일한 원소로 구성되지만 조성물은 다릅니다. 따라서, 그것은 두 가지 다른 화합물을 일으킨다.
회원 원자들 사이의 매력이 반발력의 힘보다 클 때 화합물이 형성됩니다. 화합물은 일반적으로 공유 또는 이온 결합에 의해 만들어진다. 화학적 결합에 의해 화합물을 만드는 동안 에너지가 취해 지거나 주어집니다.
공유 본딩
전자는 아래 그림과 같이 참여하는 원자에 의해 공유됩니다. 이러한 종류의 화합물을 공유 화합물이라고합니다. 두 원자가 전자 (유사한 전기성)에 유사하게 끌리는 경우, 화합물은 비극성이다. 그러나, 두 원자 사이의 전기 음성 갭이 거대하다면, 화합물은 극성이된다. 물 분자는이 현상의 가장 좋은 예입니다.
비극성 화합물-메탄, 암모니아, 헥산
극성 화합물 - 물, CF, HF 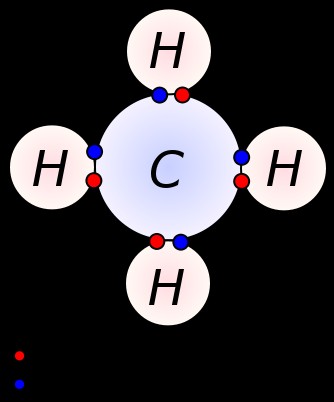
이온 결합
전자는 한 원자에서 다른 원자로 완전히 전송됩니다. 따라서, 결합에 관여하는 두 원자에 전자 전하가 나타납니다. 이들 결합에서 태어난 화합물은 주로 융점이 높은 고체이며 전류를 전도 할 수 있습니다. 금속 및 비 금속 요소는 이러한 유형의 화합물을 형성하는 데 파트너가됩니다.
화합물의 구성 요소는 물리적으로 분리 될 수 없습니다. 화학적 방법이나 전기 분해에 의해서만 분리 될 수 있습니다.
혼합물이란 무엇입니까 - 정의, 특성, 결합 유형
혼합물은 둘 이상의 요소 및/또는 화합물의 조합입니다. 이러한 구성 요소는 함께 존재하지만 화학적으로 결합되어 있거나 새로운 물질을 만들지도 않습니다. 좋은 예는 두 성분이 화학적으로 결합되지 않고 여과에 의해 개별 물질로 분리 될 수있는 모래와 물 혼합물입니다. 다른 물리적 분리 수단은 증발, 증류, 크로마토 그래피, 원심 분리 및 추출입니다. 이러한 분리 방법의 경우, 혼합물에서 성분의 물리적 특성이 고려된다. 이러한 물리적 특성 중 일부는 밀도, 크기 및 용해도입니다.
화합물의 구성 요소는 개별 특성을 유지합니다. 짠 물 용액을 맛보면 혀에 짠 맛이 느껴질 수 있습니다. 이는 소금이 물과 혼합 될 때에도 특징적인 맛을 줄 수 있음을 나타냅니다. 혼합물은 화합물처럼 자체 특성이 없습니다.
혼합물은 종종 균질하거나 이질적입니다.
균질 혼합물 - 혼합물의 구성은 전체적으로 동일합니다.
예 :- 물에 용해 된 소금
이종 혼합물 - 구성은 혼합물의 지점마다 다를 수 있습니다.
예 :- 스모그
우리가 호흡하는 공기와 광대 한 푸른 바다는 지구에서 가장 큰 혼합물로 간주 될 수 있습니다. 둘 다 이종 혼합물입니다.

화합물과 혼합물의 차이
본드
화합물 : 성분은 화학적으로 결합됩니다.
ex :- naCl, h 2 o
혼합물 : 성분은 화학적으로 결합되지 않습니다.
예 :- 짠 물, 모래 및 설탕
분리
화합물 : 구성 요소는 물리적으로 분리 될 수 없습니다. 전기 분해를 통해 분리 될 수 있습니다.
혼합물 : 여과, 크로마토 그래피, 원심 분리, 투석, 증발 및 증류와 같은 방법을 통해 성분을 물리적으로 쉽게 분리 할 수 있습니다.
특성
화합물 : 화합물은 구성 요소의 개별 특징이 아니라 자체 특성을 보여줍니다.
혼합물 : 화합물은 그들 자신의 특성을 나타내지 않습니다. 구성 요소의 개별 기능이 표시됩니다.
비율
화합물 : 구성 요소의 비율이 고정되어 있습니다.
혼합물 : 구성 요소의 비율은 다를 수 있습니다.
끓는점 및 용융점
화합물 : 끓는점과 융점은 특정 화합물에 대해 일정합니다.
혼합물 : 끓는점과 용융점은 일정하지 않습니다.
에너지 전달
화합물 : 화학적 결합을 통해 화합물을 준비하기 위해 에너지가 주어 지거나 입력됩니다.
혼합물 : 에너지 전달은 없거나 적습니다.
카테고리
화합물 : 화합물은 공유 또는 이온 성일 수 있습니다.
혼합물 : 혼합물은 균질하거나 이질적 일 수 있습니다.
참조 목록 :
"우리의 목표." 혼합물과 화합물을 구별합니다 (이론) :클래스 9 :화학 :Amrita Online Lab . N.P., N.D. 편물. 2017 년 1 월 31 일. Aphardt, Charles. "이온 성 화합물 소개." 가상 Chembook . Elmhurt College, 2003. 웹. 2017 년 1 월 31 일.